Diagrammes thermodynamiques des corps purs
Introduction
Les systèmes thermodynamiques auxquels nous nous intéressons peuvent être caractérisés par la donnée de deux variables d'état : on dit qu'ils sont bivariants. Cela signifie que leurs propriétés thermodynamiques peuvent être représentées graphiquement dans un plan, sous forme de diagramme thermodynamique.
En mettant en évidence les évolutions de référence des transformations subies par les fluides et en permettant de les calculer, au moins de manière approximative, les diagrammes font partie des outils de base du thermodynamicien. Leur intérêt est double :
permettre de représenter graphiquement les cycles ;
faciliter l'estimation de l'état thermodynamique des différents points du cycle.
Du fait des possibilités offertes par les progiciels de calcul des propriétés des fluides qui sont de plus en plus répandus, le second intérêt a tendance à diminuer tandis que le premier conserve toute son actualité. Visualiser sur un diagramme un cycle calculé à l'aide d'un outil informatisé permet notamment de s'assurer qu'il ne comporte pas de point aberrant dû à une erreur lors de l'entrée des données.
Un diagramme se présente sous forme d'un graphique plan comportant le tracé d'un certain nombre de courbes remarquables, notamment des familles d'isovaleurs des fonctions d'état.
Choix des variables à représenter
Sur le plan pratique, les principales transformations que l'on rencontre dans les processus industriels mettant en jeu des fluides purs sont des compressions, des détentes, des échanges de chaleur et des laminages.
Il est clair que la température T, la pression P et le titre en vapeur x sont des variables d'état dont la connaissance est nécessaire pour l'étude de ces processus et la conception des équipements.
L'enthalpie h est aussi très importante puisqu'elle permet de calculer les échanges d'énergie des systèmes industriels avec l'extérieur. Enfin, la connaissance du volume massique v est nécessaire pour dimensionner les conduits, puisque c'est elle qui permet de passer du débit-masse au débit-volume.
L'entropie s est la fonction d'état directement reliée aux échanges de chaleur avec l'extérieur.
En conclusion, les grandeurs les plus intéressantes sur le plan pratique sont T, P, h, s, et des informations complémentaires sur x et v peuvent être nécessaires. C'est donc parmi les quatre premières que sont choisies les abscisses et les ordonnées des diagrammes que nous pouvons considérer.
Le couple (T, h) est rarement retenu, car les isobares et les adiabatiques réversibles y sont représentées par des courbes présentant des points d'inflexion qui en rendent l'usage délicat. De plus, les variations de T et h sont proportionnelles lorsque le fluide suit la loi des gaz idéaux.
Sauf pour les gaz permanents, c'est-à-dire dont l'état est très éloigné de leurs conditions de saturation, le couple (T, P) est insuffisant, car T et P sont liés par la loi de vapeur saturante dans la zone d'équilibre liquide-vapeur. Il serait en revanche tout à fait utilisable pour représenter le cycle de la turbine à gaz.
Le couple (P, h) est de plus en plus employé, généralement avec une échelle logarithmique pour les pressions. Il correspond au diagramme dit « des frigoristes » parce que ce sont eux qui en ont généralisé l'usage.
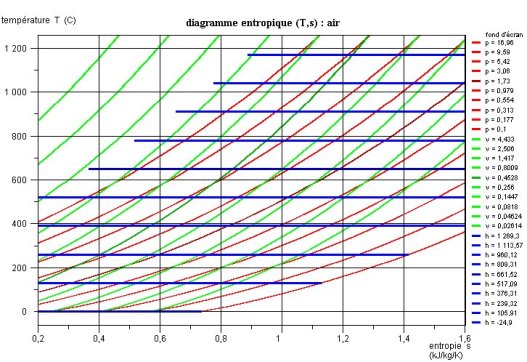
Le couple (T, s) est aussi très employé. Il correspond au diagramme dit entropique. Son intérêt est d'une part que les compressions et détentes isentropiques y sont représentées par des segments verticaux, et d'autre part qu'il se prête bien aux comparaisons avec le cycle de Carnot, comme expliqué dans la page du portail dédiée aux analyses qualitatives des cycles.
Le couple (h, s) combinaison des deux précédents a longtemps été utilisé pour l'étude des applications de la vapeur d'eau. L'intérêt est d'une part que les compressions et détentes isentropiques y sont représentées par des segments verticaux, et d'autre part que l'on peut mesurer directement sur l'axe des ordonnées les enthalpies mises en jeu.
Enfin, le couple (P, v), diagramme de Clapeyron, présente un intérêt pédagogique certain, surtout pour l'étude des transformations en système fermé. Son inconvénient principal est sa faible lisibilité, la zone des vapeurs étant réduite et les fonctions énergétiques n'apparaissant pas directement.
Dans la suite de cette page, nous ne présenterons que les diagrammes (h, ln(P)) et (T,s) qui sont les plus utilisés en pratique aujourd'hui. Une séance Diapason est consacrée aux diagrammes entropiques des gaz idéaux, et une autre aux diagrammes des vapeurs condensables.
Des activités d'auto-évaluation sur les diagrammes thermodynamiques sont disponibles dans cette page du portail. Elles vous permettront de tester vos connaissances.
Diagramme (h, ln(P)) des frigoristes
Dans le diagramme dit des frigoristes (figure ci-dessous), on porte en abscisse l'enthalpie, et en ordonnée la pression, le plus souvent selon une échelle logarithmique, afin que la zone correspondant aux basses pressions soit plus lisible.
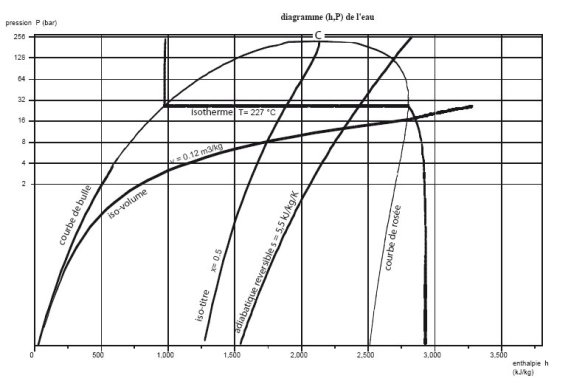
Son sommet correspond au point critique C, la partie gauche, ascendante, représente l'ébullition commençante (courbe de bulle), et sa partie droite, descendante, la vapeur saturée (courbe de rosée). Sous cette courbe se trouve le domaine de l'équilibre diphasique liquide-vapeur, et, dans le reste du plan, celui du fluide simple.
Le point critique représente l'état où la phase de vapeur pure a les mêmes propriétés que la phase de liquide pur. A des températures et pressions plus élevées (supercritiques), il n'est pas possible d'observer une séparation entre les phases liquide et gazeuse : le ménisque de surface qui sépare les phases liquide et vapeur disparaît au point critique.
Pour que ce diagramme soit utilisable, on y représente des faisceaux de courbes prédéfinies correspondant aux adiabatiques réversibles ou isentropiques, aux isothermes, aux isovolumes, et, dans la zone mixte, aux courbes d'iso-titre.
Dans la zone "liquide", à gauche du diagramme, les isothermes ont une pente négative très forte : la compression d'un liquide met en jeu un travail très faible.
Dans le domaine diphasique, la pression et la température sont liées par la loi de pression saturante, et les isothermes sont horizontales. L'enthalpie croît énormément, correspondant à la chaleur latente de vaporisation qu'il faut fournir au fluide.
Dans la zone située à droite de la courbe de vaporisation, les isothermes sont des courbes descendantes, qui se rapprochent de verticales pour les valeurs des faibles pressions. En effet, le comportement de la vapeur se rapproche alors de celui d'un gaz idéal, dont l'enthalpie ne dépend que de la température. La figure ci-dessous montre un diagramme (h, ln(P)) de gaz idéal.
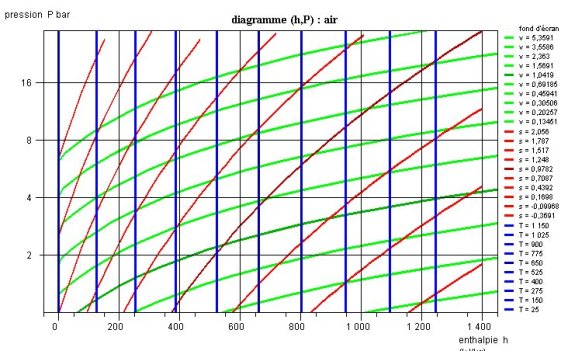
Un échauffement ou un refroidissement (isobare) se traduit dans le diagramme (h, ln(P)) par un segment horizontal, une détente sans travail (isenthalpique) par un segment vertical.
Une adiabatique réversible ou isentropique est une courbe ascendante dont la pente est égale à l'inverse du volume massique. Elles sont donc beaucoup moins inclinées dans la zone vapeur que dans la zone liquide.
Diagramme entropique (T, s)
Dans le diagramme entropique (figure ci-dessous), on porte en abscisse l'entropie et en ordonnée la température, en °C ou en K. La courbe de vaporisation sépare encore en deux le plan, délimitant la zone diphasique et la zone du fluide simple. Le point critique C se trouve toujours à son maximum.
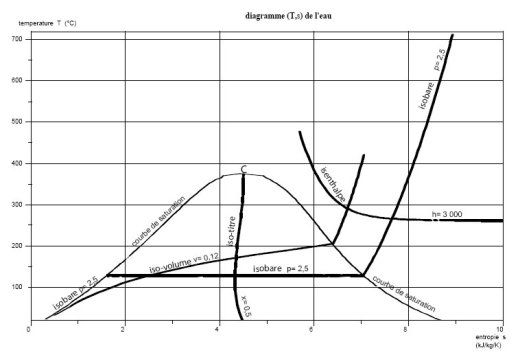
Pour certains corps, la branche droite de la courbe de vaporisation (vapeur saturante), présente un point d'entropie maximale. C'est notamment le cas pour certains hydrocarbures et pour certains chlorofluorocarbones (CFC).
A gauche de la courbe d'ébullition commençante, les isobares sont des courbes ascendantes.
La compression isentropique d'un liquide étant à peu près sans effet sur sa température, les isobares liquides sont pratiquement confondues avec la branche montante de la courbe de vaporisation. Le diagramme est donc très imprécis dans cette zone et il est préférable de recourir à une table ou un logiciel donnant les propriétés thermodynamiques le long de la courbe de vaporisation.
A l'intérieur de la zone diphasique, la température et la pression sont liées par la loi de pression saturante, et les isobares sont des horizontales.
A droite de la courbe de vaporisation, les isobares sont des courbes ascendantes qui, pour le gaz idéal, deviennent des exponentielles, qui se déduisent l'une de l'autre par des translations horizontales.
Si la pression est supérieure à la pression critique, les isobares sont des courbes strictement ascendantes, qui ne coupent pas la courbe de vaporisation.
Les isenthalpes sont des courbes à concavité tournée vers le haut, qui se rapprochent d'horizontales pour le gaz idéal, dont l'enthalpie ne dépend que de la température.La figure ci-dessous montre un diagramme entropique de gaz idéal.