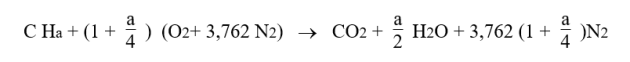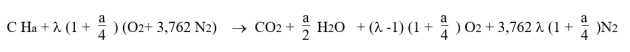Thermodynamique de la combustion
La plupart des combustibles sans cendres sont des hydrocarbures. En négligeant les traces d'azote et de soufre, leur molécule comporte essentiellement des atomes de carbone C et d'hydrogène H ainsi qu'un peu d'oxygène O.
En ramenant la formulation à un atome de carbone, la formule générale d'un combustible est donc C Hy Ox. Comme la condition x <= y/2 est toujours vérifiée, on peut considérer que la formule C Hy Ox devient :
CHa + x H2O
a représente ainsi ce qu'il est convenu d'appeler l'hydrogène disponible pour la combustion rapporté à l'oxydation complète du carbone unitaire.
L'eau contenue dans le combustible ne participe pas à la réaction de combustion. Elle se retrouve dans les fumées.
La combustion complète d'un combustible de formule CHa avec de l'oxygène pur serait régie par l'équation ci-dessous : il faut 1 molécule d'oxygène pour former CO2, et a/4 molécules d'oxygène pour former a/2 H2O.
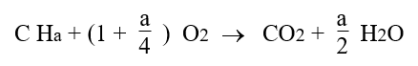
Toutefois, dans les systèmes énergétiques, les combustions sont presque toujours réalisées avec de l'air comme comburant.
L'air sec ayant comme composition volumique approchée 79 % d'azote et 21 % d'oxygène, le rapport azote/oxygène vaut 79/21 = 3,762.
C'est pourquoi l'air peut être représenté par la formulation O2+ 3,762 N2.
La combustion complète avec l'air d'un combustible de formule CHa est donc régie par l'équation ci-dessous :
On appelle combustion stœchiométrique une combustion réalisée avec la quantité exacte de comburant permettant de complètement oxyder le combustible.
C'est celle qui conduit à la température de fin de combustion la plus élevée. Nous la considérerons comme combustion de référence.
Cette équation signifie que la combustion stœchiométrique d'une mole de combustible CHa nécessite (1 + a/4) moles de dioxygène et produit 1 mole de dioxyde de carbone et a/2 moles d'eau.
Si le comburant est l'air, 3,762 (1 + a/4) moles d'azote sont aussi mises en jeu, mais, comme elles ne réagissent pas avec le combustible, elles se retrouvent dans les gaz brûlés. On dit que l'azote reste inerte.
Lorsque la combustion est non stœchiométrique, elle peut être caractérisée de plusieurs manières :
Soit par l'excès d'air e, qui comme son nom l'indique, représente la quantité d'air en excès
Soit par le facteur d'air lambda, qui est égal à 1 + l'excès d'air
Soit par la richesse R, rapport du nombre de moles (ou de la masse) de combustible contenu dans une quantité déterminée de mélange, au nombre de moles (ou à la masse) de combustible dans le mélange stœchiométrique.
R = 1 correspond au mélange stœchiométrique, R < 1 à un excès d'air, et R > 1 à un excès de combustible
Ces trois grandeurs sont reliées par les relations simples :
R = 1/(1 + e) et lambda = 1 + e = 1/R
Nous utiliserons préférentiellement lambda dans ce qui suit, car c'est le terme multiplicateur de l'air dans l'équation de la combustion.
Si lambda est supérieur à 1, c'est-à-dire en excès d'air, la combustion complète avec l'air d'un combustible de formule CHa est régie par l'équation ci-dessous :
Thermoptim utilise une généralisation de cette équation pour des combustibles plus complexes que CHa.
La comparaison des deux équations précédentes permet de comprendre ce qui se passe lorsque l'air est disponible en excès.
Le combustible réagit avec l'oxygène comme dans la réaction stœchiométrique, et tout l'air en excès se retrouve sans réagir dans les gaz brûlés.
lambda est le terme qui multiplie le nombre de moles d'air dans l'équation de la combustion.
Pour lambda = 1, la réaction est stœchiométrique.
Ce petit calculateur vous permet d'étudier l'influence de a et de lambda sur cette équation. Le tableau ci-dessous vous indique les nombres de moles des produits et leur total, la manière dont les fractions molaires sont calculées, ainsi que leurs valeurs pour le paramétrage choisi. Vous pouvez tester les deux comburants utilisés précédemment, le dioxygène ou l'air atmosphérique.
Pouvoirs calorifiques inférieur et supérieur
Lors d'une combustion, le maximum de dégagement d'énergie est obtenu lorsque l'eau contenue dans les fumées est suffisamment refroidie pour se retrouver liquéfiée, ce qui impose que leur température soit très basse. La valeur de la chaleur de réaction complète prend alors le nom de pouvoir calorifique supérieur, ou PCS.
Dans le cas le plus général où toute l'eau produite reste à l'état de vapeur, on lui donne le nom de pouvoir calorifique inférieur ou PCI.
Les enthalpies de vaporisation sont loin d'être négligeables (pour l'eau, elle vaut environ 45 MJ/kmole à 0°C). Il existe donc des différences sensibles entre les valeurs du PCS et du PCI des combustibles, et il importe de spécifier laquelle on utilise.
Les valeurs des pouvoirs calorifiques spécifiques des combustibles généralement utilisés dans les installations énergétiques sont assez proches les unes des autres. On peut en effet montrer que le PCI des hydrocarbures diminue de 44 MJ/kg à 40 MJ/kg au fur et à mesure que l'on considère des produits de distillation de plus en plus lourds.
En conclusion donc, pour déterminer les énergies mises en jeu dans une réaction de combustion complète, on utilise le pouvoir calorifique du combustible, en précisant s'il s'agit du pouvoir calorifique supérieur (PCS) ou du pouvoir calorifique inférieur (PCI).
Les combustions dans Thermoptim
Dans Thermoptim, une transfo combustion est représentée par un composant chambre de combustion comportant deux transfos en entrée, d'une part le comburant, ici de l'air en sortie de compresseur, connecté sur le port bleu, et d'autre part le combustible connecté sur le port rouge.
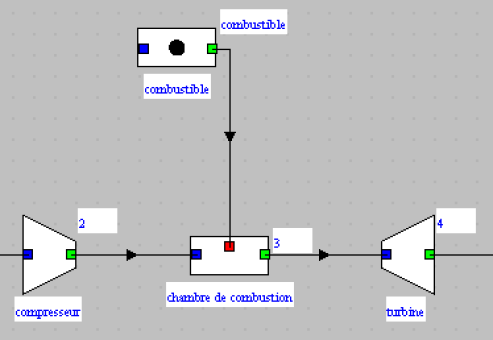
Les gaz brûlés en sortent par le port vert, ici connecté à la turbine.
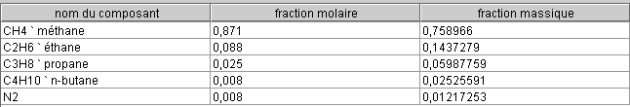
La composition du combustible est définie dans le point aval de la transfo « combustible », dont le corps doit être un gaz pur ou composé.
Celle du gaz naturel de Montoir de Bretagne est affichée ci-dessous.
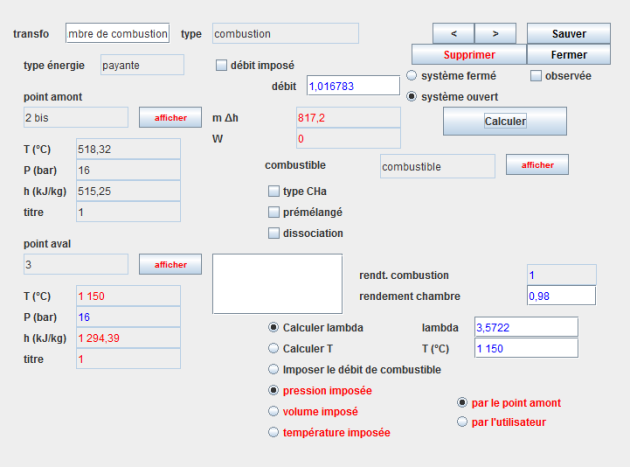
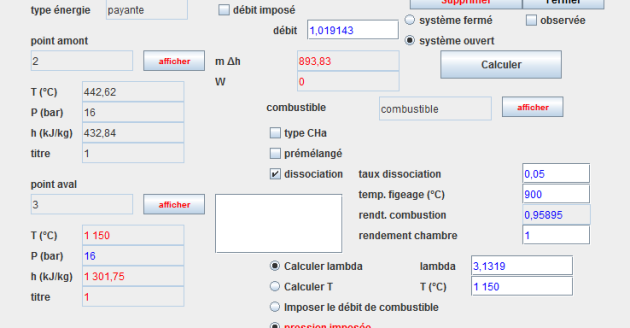
L'écran d'une combustion comporte de nombreux paramètres.
Les trois principaux modes de calcul sont les suivants :
L'option "Calculer lambda" détermine le facteur d'air lambda (>=1), à partir de la valeur de la température de fin de combustion Tc imposée.
L'option "Calculer T" détermine Tc à partir de la valeur de lambda imposée.
Dans les deux cas, le débit de la transfo "combustible" est ajusté pour que le rapport entre les débits volumiques de comburant et de combustible soit égal au facteur d'air.
L'option "Imposer le débit de combustible" détermine lambda et Tc à partir des caractéristiques du combustible et du comburant.
Le débit masse de la transfo en cours d'évaluation (la combustion) est quant à lui égal à la somme des débits de combustible et de comburant, ce qui signifie que la transfo combustion se comporte, sur le plan hydraulique, comme un mélangeur de débits.
Pour les autres paramétrages, lorsque la combustion a lieu en système ouvert, on choisit généralement la pression imposée par le point amont, ce qui signifie que la chambre de combustion est isobare.
Pour une utilisation simple de Thermoptim, ces paramétrages suffisent.
Combustions incomplètes, dissociation, température de figeage
Nous avons supposé dans ce qui précède que la combustion était complète, alors qu'il arrive que ce ne soit pas le cas, notamment à haute température, et que des imbrûlés apparaissent dans les fumées. On parle alors de dissociation.
Si, partant d'une telle situation, on baisse progressivement la température du milieu réactif, on constate qu'à partir d'un certain seuil sa composition se stabilise et ne varie plus. On dit qu'il y a figeage de la réaction et on appelle température de figeage la valeur de ce seuil.
Thermoptim peut prendre en compte ce phénomène lorsque le mode dissociation est coché, et si on lui indique d'une part le taux de dissociation du CO2 en CO, et d'autre part la valeur de la température de figeage.
Dans cet exemple, le taux de dissociation du CO2 en CO a été fixé à 5 %, et la valeur de la température de figeage à 900 °C.
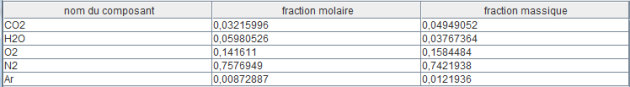
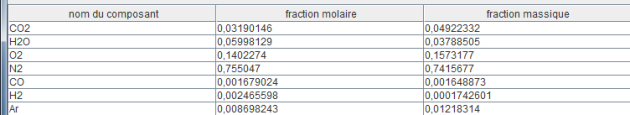
L'impact de ce changement de paramétrage sur la composition des fumées est illustré par les figures ci-dessous : du monoxyde de carbone CO et de l'hydrogène H2 apparaissent en cas de dissociation.
Un calculateur de combustions offrant plus de possibilités de paramétrage que le petit outil que nous avons présenté au début de cette page est disponible ici.