Cycles à absorption liquide
Sixième module
Le sixième module traite des cycles à absorption liquide.
Après une présentation générale du principe de ces cycles, nous étudions les problèmes posés par le calcul des mélanges de fluides réels, illustrés pour les systèmes binaires par les lentilles d'équilibre isobares et isothermes.
Les diagrammes de Oldham et de Merkel sont ensuite présentés, et des explications sont données sur leur utilisation pour visualiser des exemples de machines à absorption mettant en jeu les couples LiBr-H2O et NH3-H2O.
Thème 1 : Cycles à absorption liquide
Une machine à absorption échange de la chaleur avec au moins trois sources de chaleur à trois niveaux de température différents.
Le principal intérêt des cycles de réfrigération à absorption liquide est qu'ils ne requièrent qu'une faible puissance mécanique comparativement à leurs homologues à compression de vapeur (moins de 1%). Utilisant un cycle thermodynamique tritherme, ils permettent d'utiliser directement de la chaleur à moyenne ou haute température pour produire du froid, sans nécessiter ou presque d'apport d'énergie mécanique. A ce titre, ils ont théoriquement des rendements globaux en terme d'énergie primaire supérieurs aux cycles à compression de vapeur.
De surcroît, ils mettent en jeu des fluides dont l'impact sur la couche d'ozone et sur l'effet de serre est nul : ODP = GWP = 0. En revanche, ils nécessitent un apport de chaleur à température moyenne ou élevée, de telle sorte que leur impact indirect n'est pas nécessairement nul : tout dépend de la source d'énergie utilisée.
Lentilles d'équilibre isobares et isothermes
Le comportement des mélanges en équilibre liquide-vapeur est généralement différent de celui des corps purs, la fraction molaire ou massique de chaque constituant évoluant entre des limites qui dépendent de la pression et de la température, du fait de la distillation qui prend alors place. De par la présence de plusieurs constituants, le changement de phase est plus complexe que pour un corps pur. Sa représentation graphique dans un diagramme n'est simple que si le mélange est binaire, cas auquel nous nous limiterons dans cette introduction.
Pour bien comprendre les phénomènes qui se manifestent, étudions le comportement d'un mélange binaire de propane et de butane. Quelques-unes des propriétés de ces corps purs (pression et température critiques, températures d'ébullition à 1 et 2 bar) sont indiquées dans le tableau ci-dessous. Elles montrent que le propane est beaucoup plus volatil que le butane, puisque à 1 bar, ils s'évaporent respectivement à - 42,4 °C et 0,7 °C.
Pc (bar) | Tc (°C) | Tsat (1 bar) (°C) | Tsat (2 bar)(°C) | |
|---|---|---|---|---|
propane | 42,48 | 96,7 | -42,4 | -25,4 |
butane | 37,98 | 152,01 | -0,7 | 18,8 |
Lentille d'équilibre isobare
Considérons un mélange de ces deux corps, et examinons comment il évolue, à pression constante, lorsque sa température change. La figure ci-dessous, appelée lentille d'équilibre isobare, montre le diagramme de phase de ce mélange à la pression de 2 bar.
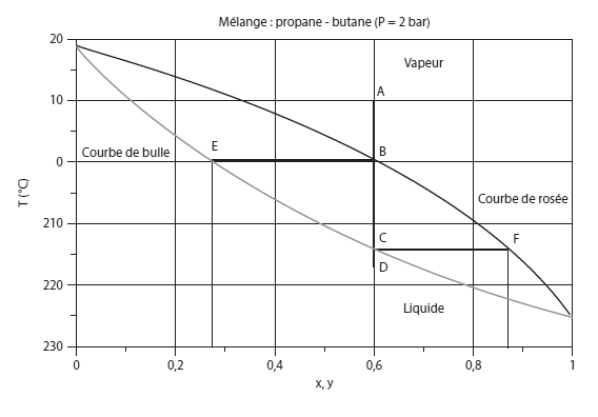
La zone vapeur correspond à la partie supérieure droite du diagramme, la zone liquide à la partie inférieure gauche, et l'équilibre liquide-vapeur à la lentille délimitée par les courbes de rosée et de bulle. L'abscisse représente la fraction molaire en propane, ce qui signifie que la valeur 0 correspond à du butane pur (Ts = 18,8 °C), et la valeur 1 à du propane pur (Ts = - 25,4 °C).
Comme c'est l'usage lors de l'étude des mélanges de vapeurs, x représente les fractions molaires en phase liquide, y les fractions molaires en phase vapeur, et z les fractions molaires globales.
L'ordonnée est la température, exprimée en °C.
Considérons un mélange de composition donnée (ici z1 = 0,6 pour le propane, z2 = 1 - z1 = 0,4 pour le butane) à l'état de vapeur, correspondant au point A de température 10 °C. Si on refroidit le mélange à pression constante (par exemple dans un échangeur), son point caractéristique se déplace le long du segment A-B vertical tant qu'il reste à l'état de vapeur.
En B, à 0 °C environ, la distillation commence sur la courbe de rosée (ou courbe de goutte), ainsi nommée parce que la première goutte de liquide apparaît. Les deux composants se liquéfient ensemble, mais, étant donné que le butane est moins volatil que le propane, il se condense davantage, de telle sorte que la composition de la première goutte diffère de la composition moyenne z. La fraction molaire x à l'état liquide du composant 1 (ici le propane) est donnée par l'abscisse du point E sur la courbe de bulle, appelée ainsi car, dans un processus inverse d'évolution de la température, c'est sur cette courbe que les premières bulles apparaissent (ici x1 = 0,28), et la fraction molaire du butane liquide est donc x2 = 1 – x1 = 0,72.
Au fur et à mesure que le refroidissement se poursuit, la composition de la phase liquide évolue, la fraction molaire du propane étant donnée par l'abscisse de l'intersection de la courbe de bulle et de l'isotherme correspondante, son point figuratif se déplaçant de E à C, tandis que celui de la phase gazeuse passe de B à F. Au point C, il ne reste que du liquide, à l'exception d'une dernière bulle de gaz, de composition y1 = 0,85 en propane et y2 = 1 - y1 = 0,15 en butane. Au-delà, le mélange reste à l'état liquide, avec sa composition initiale.
En d'autres termes, à pression donnée, le changement d'état du mélange ne se fait pas à température constante, mais avec un glissement de température (ou intervalle de distillation) qui peut être plus ou moins important selon le mélange considéré.
Par exemple, pour le mélange précédent et la pression de 2 bar, le glissement de température est de 14 °C.
Lentille d'équilibre isotherme
Examinons maintenant une évolution du mélange à température constante et pression variable. Sur le diagramme de la figure ci-dessous, appelé lentille d'équilibre isotherme, les abscisses représentent le titre en propane et les ordonnées la pression, exprimée en bar.
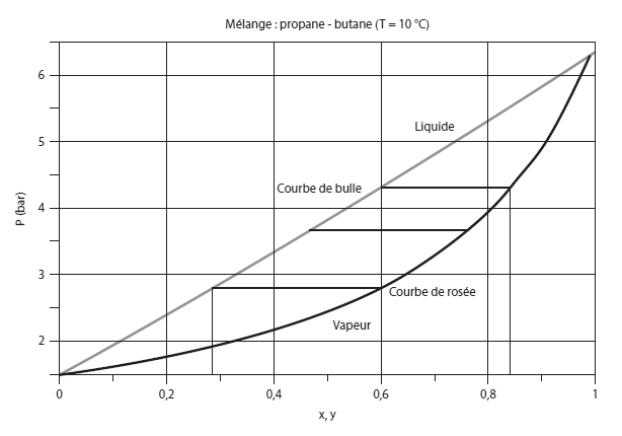
Supposons toujours que le mélange a pour composition globale (z1 = 0,6 et z2 = 0,4). Si la pression est inférieure à 2,78 bar, le mélange est entièrement à l'état de vapeur, et si elle est supérieure à 4,3 bar, il est entièrement liquide.
Entre ces deux pressions, il est en équilibre liquide-vapeur, et la composition du mélange évolue continûment dans les phases liquide et vapeur.
Pour P = 2,78 bar, la phase liquide a une composition (x1 = 0,28 ; x2 = 0,72), pour P = 3,7 bar, elle vaut (x1 = 0,48 ; x2 = 0,52), et pour P = 4,3 bar elle correspond à la composition globale.
En phase vapeur, les compositions sont les suivantes : (y1 = 0,6 ; y2 = 0,4) pour P = 2,78 bar, (y1 = 0,77 ; y2 = 0,33) pour P = 3,7 bar, et (y1 = 0,85 ; y2 = 0,15) pour P = 4,3 bar.
Mélanges azéotropes
Un cas particulier correspond aux mélanges dits azéotropes où les courbes de bulle et de rosée se rejoignent pour une composition globale donnée. On peut démontrer qu'un mélange azéotrope correspond à un extremum de pression à température constante, ou de température à pression constante. Un tel mélange se comporte en pratique comme un corps pur.
Enfin, lorsque le glissement de température est petit (< 1 °C), l'erreur que l'on commet en négligeant la distillation est très faible. On parle alors de mélange quasi-azéotrope.
C'est parce que le glissement est important, et permet de bien illustrer les phénomènes particuliers aux mélanges, que nous avons choisi ici le mélange propane / butane.
Exercices et activités personnelles sur les lentilles d'équilibre isobares et isothermes
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre connaissance des courbes des lentilles d'équilibre isobares.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre capacité de placer des points dans une lentille d'équilibre isobare.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre connaissance des courbes des lentilles d'équilibre isothermes.
Diagrammes utilisés pour les cycles de réfrigération à absorption
Les cycles à absorption liquide mettent en jeu au moins deux fluides : un solvant et un soluté (le réfrigérant).
Bien que d'autres couples soient étudiés, les seuls qui soient utilisés en pratique pour la quasi-totalité des applications sont les deux couples LiBr-H2O et NH3-H2O.
Parmi les conditions requises pour que le couple pressenti soit approprié, il faut d'une part que le solvant ait une grande affinité vis à vis du soluté, et d'autre part que ce dernier soit beaucoup plus volatil que le solvant, afin que la séparation des deux constituants soit la meilleure possible.
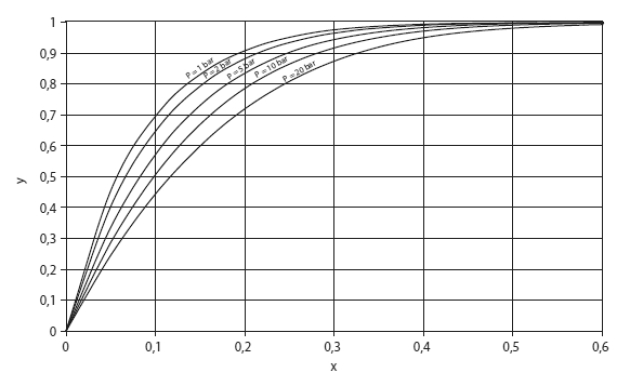
La courbe figure ci-dessous visualise, pour le couple eau-ammoniac, la relation existant entre la fraction massique de liquide et celle de la vapeur d'ammoniac, pour différentes pressions (1, 2, 5, 10 et 20 bar). Elle montre clairement que, dès lors que la fraction massique liquide du soluté x dépasse 0,4, la teneur en ammoniac de la vapeur dépasse 0,95.
Pour le mélange bromure de lithium-eau, la séparation est encore plus nette, au point que l'on peut légitimement supposer que la vapeur d'eau est pure.
Avec le couple LiBr-H2O, l'eau est le réfrigérant, ce qui impose deux contraintes : d'une part les pressions de travail sont très basses compte tenu de la loi de pression saturante de l'eau, et d'autre part la température minimale du cycle doit être supérieure à 0 °C. Les machines utilisant le couple bromure de lithium-eau ne sont utilisées qu'en conditionnement d'air.
La manière dont peuvent être calculées dans le cas général les propriétés d'un mélange de deux fluides réels est présentée dans cette page.
Pour les calculs des cycles à absorption liquide, même si on utilise généralement des équations spécifiques comme nous le verrons ci-dessous, les phénomènes physiques sont de même nature, de telle sorte que cette présentation conserve sa pertinence.
Diagramme de Oldham
Le diagramme de Oldham (figure ci-dessous) permet de visualiser les courbes de pression saturante du mélange considéré, pour différentes valeurs de sa composition (en fraction massique du soluté ou du solvant selon les cas).
La pression apparaît en ordonnée, avec une échelle logarithmique, tandis que les abscisses correspondent à la température de bulle Tb.
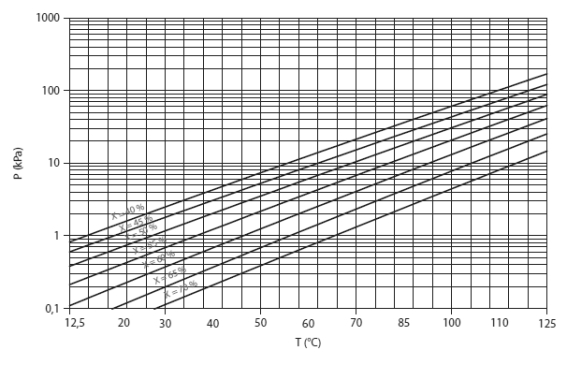
Si l'on choisit (-1/Tb) pour l'échelle des températures, les isotitres sont très proches de droites. Les extrêmes correspondent à l'équilibre liquide-vapeur des corps purs. Une évolution de la solution riche ou de la solution pauvre correspond donc à un segment de droite incliné parallèle à l'isotitre la plus proche. L'allure générale proche d'un parallélogramme des cycles dans ce diagramme a ainsi conduit les scientifiques du domaine à schématiser les architectures de leurs machines sous forme de losange.
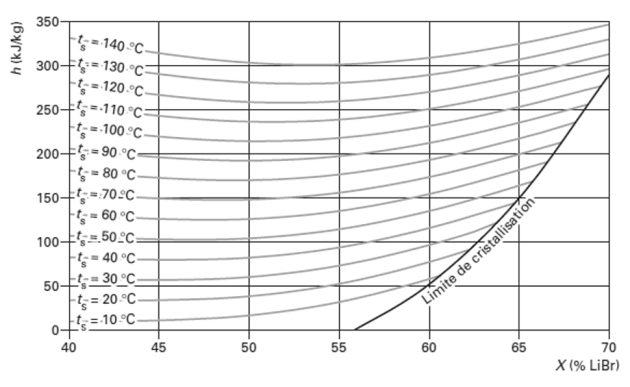
Dans les machines utilisant le mélange LiBr-H2O, la différence de tension de vapeur du solvant (LiBr) et du soluté (H2O) est telle que l'on peut négliger la fraction massique du solvant en phase vapeur, ce qui permet de simplifier les calculs : le diagramme d'équilibre peut alors être directement gradué en fonction de la température de la solution.
Ce texte à trous vous permettra de vérifier votre connaissance du diagramme de Oldham.
Équations du couple LiBr-H2O
Pour le couple LiBr-H2O, l'ASHRAE propose les équations (6.6) et (6.7), établies en généralisant au mélange la loi de tension saturante du réfrigérant (l'eau), dans laquelle la température de l'eau t' (°C) est remplacée par une fonction linéaire de la température de la solution t (°C). P, exprimée à partir du logarithme décimal, est la pression en kPa, et X la fraction massique du mélange en LiBr.
Ces équations, qui ont servi à établir le diagramme de la figure ci-dessus, sont valables dans les intervalles de valeurs suivantes :
-15 < t' < 110 °C, 5 < t < 175 °C, 45 < X < 70 %.
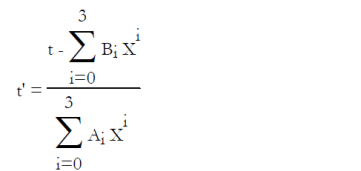
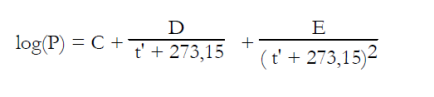
A0 | -2,00755 | B0 | 124,937 | C | 7,05 |
A1 | 0,16976 | B1 | -7,71649 | D | -1596,49 |
A2 | -3,13E-03 | B2 | 0,152286 | E | -104095,5 |
A3 | 1,98E-05 | B3 | -7,95E-04 |
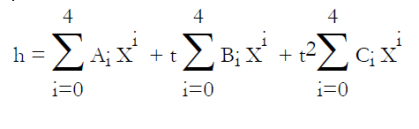
A0 | -2024,33 | B0 | 18,2829 | C0 | -0,03700821 |
A1 | 163,309 | B1 | -1,1691757 | C1 | 2,89E-03 |
A2 | -4,88161 | B2 | 0,03248041 | C2 | -8,13E-05 |
A3 | 0,06302948 | B3 | -4,03E-04 | C3 | 9,91E-07 |
A4 | -2,91E-04 | B4 | 1,85E-06 | C4 | -4,44E-09 |
Ce mélange est disponible dans la modélothèque.
Diagramme de Merkel
Le diagramme de Oldham est facile à comprendre et à utiliser, mais, tout comme les lentilles d'équilibre isobares ou isothermes, il présente l'inconvénient de ne fournir aucune information sur les énergies mises en jeu.
Le diagramme de Merkel (ou diagramme enthalpie-concentration) est quant à lui construit avec l'enthalpie comme ordonnée, et la fraction massique du soluté (ou souvent du solvant pour le couple LiBr-H2O) en abscisse. Il permet ainsi de superposer les informations de plusieurs lentilles d'équilibre isobares tout en faisant apparaître les enthalpies. On trouvera ci-dessous le diagramme de Merkel du mélange ammoniac-eau.
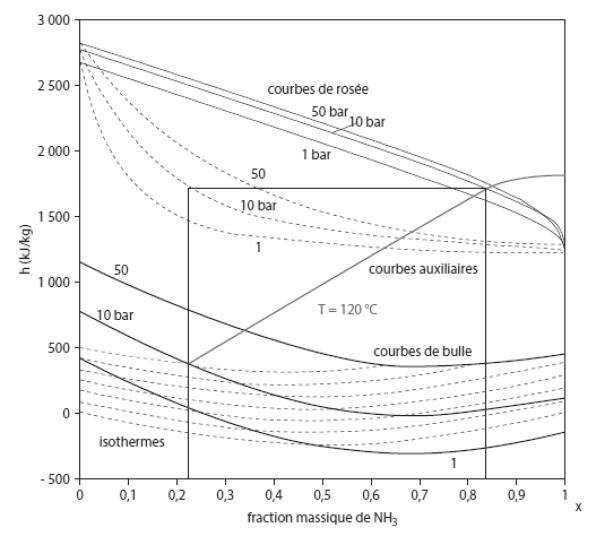
Il comprend cinq types de courbes :
un faisceau de courbes de bulle à P = Cste, en traits continus à concavité tournée vers le haut ;
un faisceau de courbes de rosée pour les mêmes pressions, en traits continus à concavité tournée vers le bas ;
un faisceau d'isothermes en zone liquide, en traits pointillés dans la partie basse du diagramme, valable quelle que soit la pression, l'influence de la pression sur l'enthalpie du liquide étant en première approximation négligeable (à titre d'exemple, l'écart d'enthalpie de la solution liquide à 30 % d'ammoniac en masse varie à 0 °C de 5 kJ/kg lorsque la pression passe de 0,5 à 50 bar, tandis que la partie utile du diagramme couvre plus de 1000 kJ/kg dans la zone liquide) ;
un ensemble de courbes dites auxiliaires ou de construction, en traits pointillés dans la partie haute du diagramme, qui permet, pour une pression donnée, connaissant la fraction massique en soluté du liquide x, de déterminer la fraction massique en soluté de la vapeur y ;
un faisceau d'isotitres en frigorigène de la phase vapeur, qui permet, pour une pression donnée, de connaître la fraction massique en liquide correspondant à l'isotitre vapeur choisi (ce dernier ensemble de courbes est parfois omis du diagramme de Merkel, comme sur cet exemple).
En revanche, on ne fait pas apparaître dans le diagramme de Merkel les isothermes dans la zone vapeur, car elles dépendent de la pression et le diagramme deviendrait illisible.
Les valeurs numériques pour la construction de ce diagramme ont été obtenues à partir des équations proposées par Ziegler et Trepp implémentées dans CTP Lib.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre connaissance des courbes du diagramme de Merkel.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre capacité de placer des points dans le diagramme de Merkel.
Machine à absorption LiBr-H2O
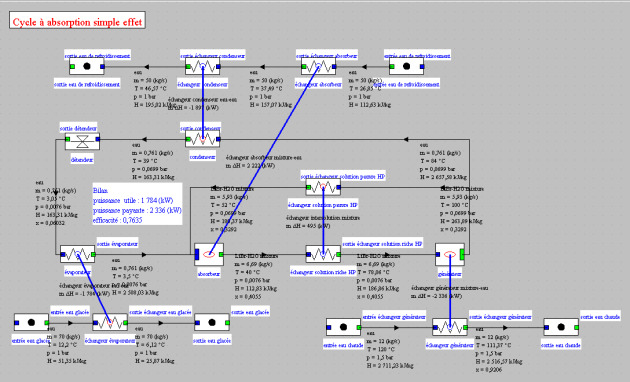
Un cycle de machine à absorption utilisant le couple LiBr-H2O comporte huit éléments principaux :
un désorbeur, qui reçoit de la source chaude un flux de chaleur, et dans lequel entre la solution riche à haute pression, préchauffée dans l'échangeur de solution (B). Il en sort d'une part la vapeur de réfrigérant (H2O) presque pure (C), et d'autre part la solution appauvrie (A) ;
le condenseur, dont sort la vapeur de réfrigérant, condensée et éventuellement sous-refroidie (I), la chaleur extraite étant rejetée à l'environnement ;
un détendeur de réfrigérant, qui réduit la pression du réfrigérant liquide, qui en sort à l'état diphasique à basse température (L) ;
un évaporateur dans lequel le réfrigérant à basses pression et température est vaporisé et éventuellement légèrement surchauffé (J), en prélevant à la source froide le flux de chaleur utile (effet frigorifique) ;
un absorbeur, dans lequel entrent le réfrigérant vaporisé (J) et la solution pauvre préchauffée dans l'échangeur de solution (E), et duquel sort la solution riche (D), la chaleur extraite étant rejetée à l'environnement ;
un échangeur de solution, qui permet d'effectuer une régénération interne entre la solution riche et la solution pauvre ;
une pompe est nécessaire pour pressuriser la solution riche avant son entrée dans l'échangeur ;
un détendeur en sortie d'échangeur ramène la solution pauvre à la pression de l'absorbeur.
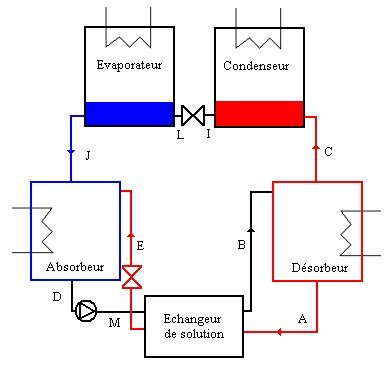
On notera que le condenseur, le détendeur de réfrigérant et l'évaporateur fonctionnent de la même manière que dans un cycle frigorifique à compression de vapeur.
Tout se passe donc comme si le compresseur d'un cycle de réfrigération classique était remplacé par les composants situés dans la partie basse de la figure ci-dessus.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre bonne compréhension de la structure d'une machine à absorption.
Composants spécifiques à un cycle à absorption
Absorbeur
Comme son nom l'indique, c'est dans l'absorbeur que prend place l'absorption du frigorigène dans la solution pauvre. L'opération étant exothermique, il est nécessaire de refroidir l'absorbeur. Le schéma d'un absorbeur est donné figure ci-dessous.
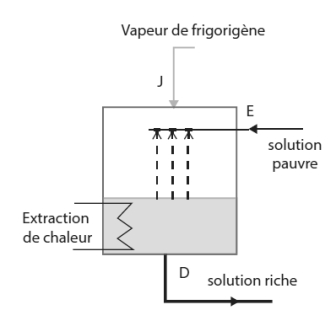
La solution pauvre sort sous forme de gouttelettes des buses situées en haut de l'appareil et vient ainsi lessiver la vapeur de frigorigène qui sort de l'évaporateur.
La surface de contact entre les deux fluides étant très grande, le phénomène d'absorption est facilité. La concentration en soluté augmente progressivement dans l'appareil, de telle sorte que la solution qui en sort est riche en frigorigène.
L'absorbeur travaille à la basse pression du cycle et à température intermédiaire entre les températures saturantes du frigorigène à basse et haute pression. En conséquence la solution riche doit être mise en pression par une pompe avant d'être dirigée vers le désorbeur.
Désorbeur ou générateur
La fonction principale du désorbeur, encore appelé générateur, est d'extraire le frigorigène de la solution riche pour produire de la vapeur de frigorigène à haute pression qui pourra être condensée dans le condenseur de l'appareil. Le schéma d'un désorbeur est donné figure ci-dessous.
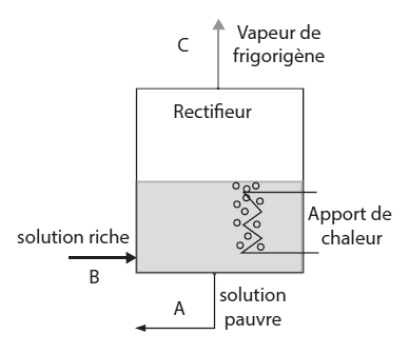
La solution riche entre en bas de l'appareil. Elle y est réchauffée grâce à un apport de chaleur à haute température qui la fait bouillir. Compte tenu de la différence de volatilité du frigorigène et du solvant, les bulles produites contiennent presque exclusivement du frigorigène.
C'est totalement le cas pour le couple couples LiBr-H2O. Dans le cas du mélange NH3-H2O, un petit peu d'eau est aussi vaporisée, et on doit utiliser un deuxième appareil appelé rectifieur pour l'extraire afin que la vapeur d'ammoniac soit à peu près pure.
Deux fluides sortent du désorbeur : la solution appauvrie en frigorigène dans la partie basse, et la vapeur de frigorigène dans la partie haute.
Échangeur de solutions
La solution pauvre sortant du désorbeur à une température supérieure à celle de la solution riche issue de l'absorbeur, il est thermodynamiquement justifié d'utiliser un échangeur de chaleur entre les deux fluides, que l'on appelle l'échangeur de solutions.
Modélisation du cycle
Pour modéliser un tel cycle, nous avons créé dans la modélothèque deux nœuds externes qui mettent en jeu le couple LiBr-H2O, dont les propriétés sont modélisées dans un corps externe particulier.
Comme nous l'avons vu dans la section précédente, la machine à absorption échange de la chaleur avec l'extérieur sous trois formes :
un apport à haute température pour le désorbeur
une extraction à moyenne température pour l'absorbeur
l'effet frigorifique utile au niveau de l'évaporateur
La représentation des couplages thermiques du désorbeur et de l'absorbeur est possible en utilisant deux thermocoupleurs, nommés respectivement "apport de chaleur" et "refroidissement" sur le schéma de la figure ci-dessous : chaque nœud externe calcule l'énergie thermique qui doit être échangée, et chaque thermocoupleur recalcule la transfo "échange" à laquelle il est connecté.
L'effet frigorifique est quant à lui modélisé par un échangeur classique.
Sur le synoptique de la figure ci-dessus, on reconnaît dans la partie centrale la machine à absorption, avec les trois sources avec lesquelles elle échange de la chaleur : en haut le circuit de refroidissement à moyenne température, en bas à gauche l'eau réfrigérée, et en bas à droite la vapeur à haute température.
Dans ce synoptique on a comptabilisé comme énergie utile l'effet frigorifique et comme énergie payante l'énergie thermique fournie au désorbeur, ce qui conduit à un COP du cycle à absorption à simple effet égal à 0,76.
Un exemple simple de cycle à absorption utilisé en trigénération a été étudié dans le module sur la cogénération.
La fiche-guide de TD n°12 vous permet de vous initier à la modélisation ce cycle.
Références
ASHRAE, Fundamentals Handbook (SI), Thermophysical properties of refrigerants, 2001.
Ziegler B., Trepp Ch., Equation of state for ammonia-water mixtures, Revue Internationale du Froid, Vol. 7, Number 2, Butterworth, march 1984
Connaissances acquises
Grâce à ce programme, à la fin du module, vous :
connaîtrez les lentilles d'équilibre isobares et isothermes et saurez les utiliser pour représenter les systèmes binaires
saurez vous repérer dans les diagrammes de Oldham et de Merkel
saurez utiliser ces diagrammes pour calculer les machines à absorption mettant en jeu les couples LiBr-H2O et NH3-H2O