Mélanges humides, climatisation
Cinquième module
Le cinquième module traite des mélanges humides et de la climatisation.
Nous commençons par présenter la thermodynamique des mélanges humides et en particulier les diagrammes psychrométriques dans lesquels les cycles de climatisation peuvent être représentés, puis nous expliquons comment peuvent être calculés les transformations utilisées en climatisation (mélanges humides, chauffage, refroidissement adiabatique et humidification à la vapeur ou à l'eau, dessication, détermination des conditions de soufflage).
Deux exemples de climatisation de bâtiments sont traités, l'un pour les conditions estivales, l'autre pour les conditions hivernales.
Thème 1 : Mélanges humides
Un certain nombre de gaz utilisés couramment sont des mélanges dont la composition peut varier du fait de la condensation ou de la vaporisation de l'un de leurs composants. En pratique le constituant qui change d'état est le plus souvent l'eau, ce qui justifie qu'une page particulière de ce portail traite des mélanges de gaz et de vapeur d'eau, dénommés ci-après mélanges humides.
L'air sec en particulier ne se rencontre pratiquement jamais : il comprend presque toujours de l'eau, sous forme gazeuse, liquide ou de cristaux de glace. La maîtrise de l'hygrométrie de l'air détermine les conditions de confort des ambiances, ainsi que la conservation des aliments et de nombreux produits. Elle s'obtient grâce à des techniques de climatisation.
Nous nous contenterons ici de présenter les principes de calcul des propriétés thermodynamiques des mélanges humides. Même s'il est certain que les applications pratiques les plus nombreuses concernent l'air, notre présentation concernera tous les gaz pour lesquels nos hypothèses seront valables, c'est-à-dire à la grande majorité des cas. Par exemple, les propriétés hygrométriques des produits de combustion, qui contiennent presque toujours de l'eau, peuvent être déterminées selon les méthodes présentées ici.
Définitions et conventions
Lorsqu'on s'intéresse à un mélange humide, on a affaire à un mélange de gaz qui ne se condensent pas, que nous appellerons le gaz sec, et d'eau, susceptible de se condenser. Précisons que nous n'étudierons pas ici les brouillards, de telle sorte que nous pourrons supposer que le volume occupé par l'eau éventuellement condensée reste très faible devant celui qu'occupe la phase gazeuse, ce qui nous permettra de le négliger. Dans ces conditions, pour un volume donné, la masse totale de la phase gazeuse peut varier, alors que la masse des constituants incondensables reste toujours constante. C'est pourquoi il est d'usage de rapporter l'ensemble des propriétés thermodynamiques du mélange composant la phase gazeuse à la masse invariante, qui est celle du gaz sec.
Tout se passe en quelque sorte comme si le mélange humide était un mélange de deux corps : le gaz sec, dont la composition est invariable, et l'eau, susceptible de se présenter sous une ou plusieurs phases. Comme on le verra par la suite, il est fondamental pour mener les calculs de bien spécifier à quel corps se rapportent les grandeurs thermodynamiques utilisées, et quelles sont les unités de référence et leur origine. Les notations seront choisies en conséquence.
On appelle humidité spécifique w le rapport de la masse d'eau contenue dans un volume donné de mélange humide à la masse de gaz sec contenue dans ce même volume.
L'eau contenue dans un mélange humide peut être caractérisée de différentes manières : par son humidité spécifique, que nous venons d'introduire, mais aussi plus classiquement par sa fraction molaire ou massique, ou encore par sa pression partielle qui présente ici un intérêt particulier. Tant que la pression partielle de l'eau reste inférieure à sa pression de saturation à la température du gaz, l'eau se présente sous forme de vapeur, sinon elle existe en partie à l'état condensé liquide ou solide. Il existe donc une limite supérieure à la quantité de vapeur d'eau qui peut être contenue dans un mélange humide. Elle dépend de la température et de la pression. Lorsque, à pression donnée, la température descend en dessous de la pression de vapeur saturante de l'eau, la vapeur d'eau commence à se condenser sous forme de brouillard ou sur les parois froides qui délimitent le système s'il en existe.
Compte tenu de son importance pratique, l'état saturé sert de référence, et on appelle humidité relative ε le rapport de la pression partielle de la vapeur d'eau à sa pression de vapeur saturante. Ce rapport est égal à 1 (ou 100 %) lorsque la vapeur commence à se condenser. Sinon, il est inférieur à 1.
On appelle respectivement enthalpie spécifique q' et volume spécifique vspé l'enthalpie et le volume du mélange humide rapportés à 1 kg de gaz sec.
Ce texte à trous vous permettra de vérifier votre connaissance des définitions utilisées pour les mélanges humides.
Principes de calcul
On sait qu'un fluide liquéfiable reste assimilable à un gaz idéal jusqu'au voisinage immédiat de l'état liquide lorsque sa pression est très inférieure à sa pression critique. Lorsque ce fluide est un constituant d'un mélange, cette règle s'applique en prenant en compte la pression partielle.
Tant que l'état liquide n'apparaît pas, le mélange se comporte donc comme un gaz idéal. Lorsque la température du mélange s'abaisse au dessous de la température de condensation correspondant à la pression partielle du constituant liquéfiable dans le gaz sec, l'état liquide commence à apparaître. Dans la plupart des cas, bien que ce ne soit pas rigoureusement vrai, on est en droit de considérer que cette phase[1] liquide est pure, formée exclusivement du constituant liquéfiable.
A ce moment, sous réserve que l'équilibre[2] soit établi, l'expérience montre que la situation est la suivante :
la relation d'équilibre liquide-vapeur est vérifiée par le constituant liquéfiable, comme si les autres constituants n'existaient pas. Sa pression partielle, donnée par la loi de pression saturante, vaut donc Pvs = Ps(T) ;
la loi de Dalton s'applique pour le calcul des fonctions thermodynamiques de la phase[1] gazeuse ;
la loi du mélange des phases s'applique pour le calcul des fonctions thermodynamiques de l'ensemble phase[1] liquide - phase[1] gazeuse (on suppose que les tensions interfaciales sont négligeables).
Pour calculer les propriétés thermodynamiques du mélange en présence d'une phase[1] liquide, on procède donc comme suit :
connaissant la température du milieu, on peut déterminer la pression partielle du constituant liquéfiable. On en déduit la somme des pressions partielles (P - Pvs) des autres constituants. Comme on connaît leurs fractions molaires relatives, on peut déterminer complètement la composition de la phase gazeuse, et le nombre de moles du constituant liquéfiable à l'état gazeux. Par différence, on connaît le nombre de moles liquéfiées ;
les lois de Dalton et du mélange des phases permettent ensuite de calculer toutes les propriétés du mélange. Il est évident que, dans ce cas, la composition du mélange évoluant en fonction du titre du constituant liquéfiable, il faut en tenir compte dans le calcul des propriétés thermodynamiques.
Dans Thermoptim le calcul des mélanges humides est effectué selon cette méthode. Il est ainsi possible d’étudier le comportement d’un mélange de vapeur d’eau et d’un gaz de composition quelconque.
Principales relations
Nous utiliserons les indices gs pour qualifier le gaz sec, et gh pour le mélange humide.
Cas où l'on connaît la composition du mélange humide
Par définition de la pression partielle de l'eau :
Pvap = xH2O . P (33)
La masse molaire du gaz sec est :
Mgs = 1/(1 - xH2O)S Minc xinc (34)
inc représentant les divers constituants incondensables
L'humidité spécifique w est alors, par définition :
w = yH2O/ygs = MH2O xH2O / Mgs / xgs (35)
L'humidité relative ε est donnée par les relations suivantes :
si Pvs est la pression de vapeur saturante de l'eau :
Si Pvap < Pvs, ε = Pvap/Pvs
w = MH2O / Mgs . Pvap / (P - Pvap) (36)
Si Pvap > Pvs, ε = 1
w = wsat = MH2O / Mgs . Pvs / (P - Pvs) (37)
Les valeurs du volume et de l'enthalpie spécifique q' peuvent alors être déterminées, cette dernière étant calculée avec un zéro des enthalpies à 0 °C.
Généralement (et c'est le cas dans Thermoptim) l'état de référence, ou zéro, pour le calcul des enthalpies des gaz est pris à la valeur standard de 298 K. Or, les ingénieurs climaticiens ont coutume de choisir comme état de référence 0 °C pour l'air sec, et 0 °C, liquide saturé pour l'eau. Il en résulte un décalage entre les enthalpies des gaz humides telles qu'on les calcule habituellement et celles qui sont représentées sur les diagrammes psychrométriques usuels. Cet écart varie en fonction de l'humidité spécifique.
En pratique, les enthalpies peuvent être rapportées à trois références différentes, qu'il faut savoir bien distinguer sous peine de faire des erreurs. Dans ce qui suit, nous utiliserons selon les cas :
l'enthalpie massique du mélange humide hgh (hgh = 0 à T = 298 K)
l'enthalpie massique du gaz sec hgs (hgs = 0 à T = 298 K)
l'enthalpie spécifique du mélange humide q' (q' = 0 à T = 0 °C, eau liquide)
En général, sauf indications contraires, la première est celle que l'on emploie par défaut, tandis que dans les calculs particuliers aux mélanges humides, c'est généralement la troisième forme qui est utilisée.
Dans ce qui suit, l'indice eau indique que le calcul est effectué avec les équations de l'eau considérée comme un fluide réel, et l'indice H2O qu'il est mené avec les équations de l'eau assimilée à un gaz parfait. hveau est l'enthalpie de l'eau à l'état vapeur, et L0eau représente l'enthalpie de vaporisation de l'eau à 0 °C.
q'(t,w) = hgs(t) - hgs(0°C) + w hveau(t, Pvap) (39)
ou encore, en faisant l'approximation que la vapeur d'eau se comporte comme un gaz idéal :
q'(t,w) = hgs(t) - hgs(0 °C) + w [hH2O(t) - hH2O(0 °C)] + w L0eau (40)
En introduisant hgh, enthalpie du mélange humide (idéal) :
hgh(t) = (hgs + w hH2O(t)) / (1 + w) on obtient :
q'(t,w) = (hgh(t) - hgh(0 °C)) (1 + w) + w L0eau (41)
De même, vspéc = vgh (1 + w)
Dans la zone sursaturée, le gaz est saturé d'eau à l'état vapeur, le reste de l'eau étant à l'état liquide. L'enthalpie spécifique est alors donnée par :
q'(t,w) = hgs(t) - hgs(0°C) + w hveau(t, Pvs)
Cas où l'on connaît la composition du gaz sec
Dans le cas où l'on connaît la composition du gaz sec, les calculs sont menés légèrement différemment, car w est alors une donnée.
On en déduit, Mgs étant la masse molaire du gaz sec :
Pvap = P w Mgs / MH2O /(1 + w Mgs / MH2O) (42)
ε = Pvap/Pvs (43)
Les autres calculs sont menés comme précédemment.
Températures utilisées pour les mélanges humides
L'étude des mélanges humides conduit à introduire plusieurs températures, dont il importe de bien connaître la définition, car, pour un même état du gaz, leurs valeurs peuvent être sensiblement différentes.
On appelle température sèche t (en °C) ou T (en K), ou plus précisément température de bulbe sec la température indiquée par un thermomètre dont la partie sensible est parfaitement sèche, et qui est placé dans le mélange humide. Il s'agit de la température au sens habituel du terme.
On appelle température de rosée tr (en °C) ou Tr (en K) la température à laquelle les premières gouttelettes commencent à apparaître si on refroidit à humidité et pression constantes un mélange humide. Si l'eau se condense sous forme de glace, on parle aussi de température de givre. Il s'agit de la température saturante de l'eau à la pression partielle Pvap.
Avec les notations précédentes, Tr = Tsat(Pvap) si Pvap < Pvs, et Tr = Tsat (Pvs) = T sinon.
On appelle température humide t' (en °C) ou T' (en K), ou plus précisément température de bulbe humide la température indiquée par un thermomètre dont l'élément sensible est recouvert d'une fine pellicule d'eau en cours d'évaporation du fait d'un fort brassage du gaz. En pratique, on recouvre le bulbe du thermomètre par une mèche imbibée d'eau. Si elle est mesurée dans de bonnes conditions, cette température est sensiblement égale à la température de saturation adiabatique que l'on obtiendrait en humidifiant le gaz jusqu'à la saturation dans un appareil adiabatique, en l'aspergeant d'eau à la température d'équilibre.
On peut montrer que sa valeur est donnée par l'équation suivante :
enthalpie liquide de l'eau à t' . ( humidité saturée à t' - humidité initiale) = = enthalpie du mélange saturé à t' - enthalpie du mélange initial à t.
Rapportée au gaz sec, l'équation s'écrit :
hleau(t') (wsat - w) = hgs(t') - hgs(t) + wsat hveau (t') - w hveau(t) (44)
Rapportée aux unités spécifiques, elle devient :
q'(t', wsat) - q'(t,w) = (wsat - w) hleau(t') (45)
Il s'agit d'une équation implicite en t', mettant en jeu le mélange formé d'une part par le gaz sec, et d'autre part par l'eau. Elle peut être inversée dans un intervalle de température compris entre une valeur proche de la température de rosée comme valeur minimale, et la température sèche comme valeur maximale.
Comme indiqué plus haut, il faut prendre garde à ce que les valeurs de référence des enthalpies soient cohérentes entre elles. De plus, lorsque t ou t' devient inférieur à 0 °C, les équations de l'eau liquide doivent être remplacées par celles de l'eau solide.
Ce texte à trous vous permettra de vérifier si vous savez différencier les différentes températures utilisées pour les études de mélanges humides.
Diagrammes des mélanges humides (diagrammes psychrométriques)
Les principales relations thermodynamiques que nous venons de donner montrent que les variables et fonctions d'état des mélanges humides sont reliées par des équations relativement complexes, qui justifient de chercher une présentation graphique simple d'emploi.
Deux grandes familles de diagrammes existent : les diagrammes dérivés de celui proposé par Carrier, avec la température sèche en abscisse et l'humidité spécifique en ordonnée (à gauche, figure ci-dessous), et les diagrammes de Mollier (à droite, figure ci-dessous), avec l'humidité spécifique en abscisse et l'enthalpie spécifique en ordonnée.
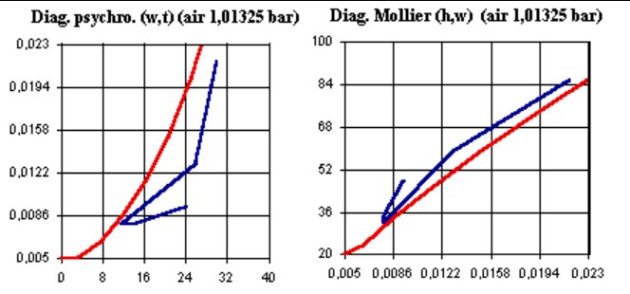
Sur la figure ci-dessus, la courbe régulière en rouge à concavité tournée vers le haut dans le diagramme de Carrier (à gauche) et vers le bas dans le diagramme de Mollier (à droite) est la courbe de saturation en eau du gaz. On a représenté en bleu le tracé d'un cycle de climatisation.
Diagramme de Carrier
Dans le diagramme de Carrier, la zone située au dessus de la courbe de saturation correspond aux cas où l'eau est en excès et existe sous forme condensée liquide ou solide : le gaz est sursaturé. Dans le diagramme de Mollier, c'est l'inverse : cette zone est située au dessous de la courbe de saturation.
Le diagramme de la figure ci-dessous correspond à l'air à la pression atmosphérique. Il est équipé de différentes isovaleurs :
les courbes d'égale humidité relative ε sont des courbes en bleu à concavité tournée vers le haut ;
les isenthalpes sont les courbes en rouge très proches de droites et les isothermes humides les courbes en vert qui leur sont presque parallèles (en général non représentées) ;
les isovolumes sont les courbes en magenta très proches de droites de pentes négatives plus fortes que les précédentes.
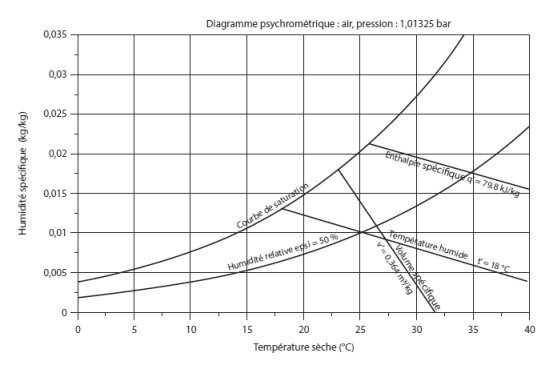
Diagramme de Mollier
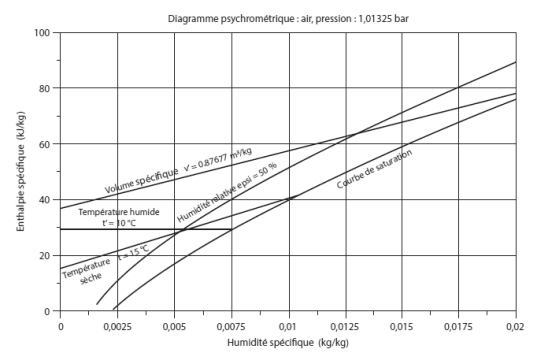
Le diagramme de Mollier de la figure ci-dessous est lui aussi établi pour l'air à la pression atmosphérique. Il est équipé de différentes isovaleurs :
les courbes d'égale humidité relative sont les courbes en bleu à concavité tournée vers le bas ;
les isothermes sèches sont les courbes en rouge très proches de droites et les isothermes humides les courbes en vert qui sont presque parallèles à l'axe des abscisses ;
les isovolumes sont les courbes en magenta très proches de droites de pentes positives.
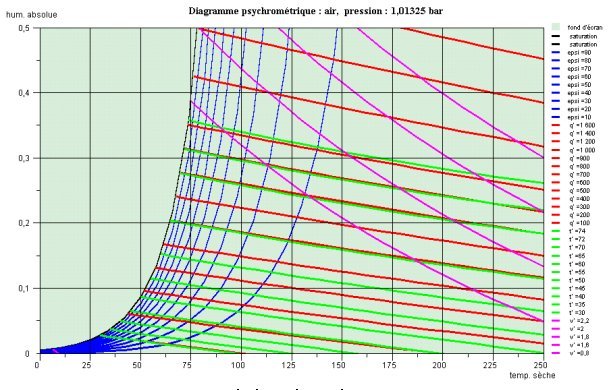
A la pression atmosphérique et au delà de 100 °C, il est impossible de condenser l'eau. Sur le diagramme de Carrier, cela se traduit par une tangente quasi-verticale sur la courbe de saturation pour la température de 100 °C, et sur le diagramme de Mollier par une asymptote pour la courbe de saturation, correspondant à l'isotherme sèche 100 °C.
Exercices
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre connaissance des courbes du diagramme de Carrier.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre capacité de placer des points dans le diagramme de Carrier.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre connaissance des courbes du diagramme de Mollier.
Cet exercice de glisser-déposer sur image vous permettra de vérifier votre capacité de placer des points dans le diagramme de Mollier.
Thème 2 : Climatisation
La principale application pratique des développements précédents est la climatisation qui sert à contrôler la température et l'humidité dans les environnements intérieurs, mais le problème est plus général.
Les principales transformations que peuvent subir des mélanges humides sont les suivantes :
des mélanges
des chauffages
des refroidissements, avec ou sans condensation de l'eau
des humidifications, par de l'eau ou de la vapeur
des déshumidifications
enfin, pour les applications de climatisation de l'air, il est souvent utile de déterminer les conditions de soufflage permettant d'obtenir une ambiance désirée.
Vous trouverez dans cette page une présentation de ces opérations élémentaires et les technologies associées, avec les équations mises en jeu, et indication de comment elles peuvent être déterminées grâce à Thermoptim et représentées dans les diagrammes des mélanges humides.
Texte à trous
Ce texte à trous vous permettra de vérifier si vous avez bien compris comment les conditions de soufflage peuvent être déterminées.
Aspects technologiques
La figure ci-dessous montre comment se présente une installation de climatisation et comment elle s'intègre dans un bâtiment.
Le local est représenté dans la partie inférieure droite. Il possède deux ensembles de veines de circulation d'air, l'une pour l'extraction, l'autre pour le soufflage. Pour climatiser le local, on "souffle" un certain débit d'air par des bouches d'aération. Cet air soufflé se mélangeant avec l'air du local, un équilibre thermique et hydrique est réalisé.
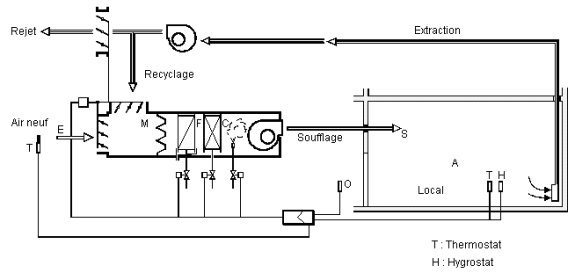
Les conditions de soufflage sont déterminées de telle sorte que cet équilibre corresponde aux conditions de confort souhaitées.
L'air extrait est pour partie rejeté à l'extérieur, et pour partie recyclé, le taux de recirculation dépendant des normes hygiéniques en vigueur. L'air recyclé est mélangé à de l'air neuf, éventuellement préchauffé, puis le mélange est "traité" pour que son état corresponde aux conditions de soufflage désirées.
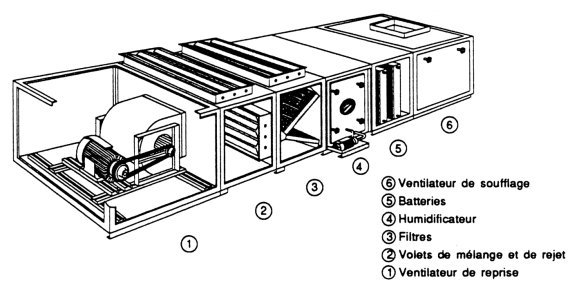
La figure ci-dessous montre l'éclaté d'une veine de traitement de l'air faisant apparaître différents caissons comprenant un ventilateur de reprise, un mélangeur, des filtres, un humidificateur, des batteries et un ventilateur de soufflage.
Conception d'une installation
La conception d'une installation de climatisation comporte une série d'étapes distinctes :
il faut tout d'abord déterminer les conditions climatiques de référence qui seront utilisées pour calculer les charges enthalpiques et hydriques. En pratique, on se base sur les données climatiques publiées par les services météorologiques nationaux, que l'on corrige éventuellement comme indiqué ci-dessous. Les valeurs à prendre en considération ne sont pas les conditions extrêmes mais celles susceptibles d'être atteintes ou dépassées quelques jours par an en moyenne. Pour l'hiver, des corrections doivent être apportées aux températures pour les sites en altitude (- 1 °C tous les 200 m) et pour les villes (+ 1 à 2 °C selon la taille de l'agglomération), et une estimation des humidités relatives peut être obtenue simplement (100 % au bord du littoral ou d'un lac, 90 % ailleurs) ;
les conditions d'ambiance doivent ensuite être définies. Pour les applications industrielles ou spécifiques, on se reportera aux indications des Guides de l'AICVF. Pour la climatisation de confort, on notera que la plupart des personnes en bonne santé ne ressentent pas de différence notable tant que l'humidité relative reste comprise entre 30 et 60 % et que la température est inférieure à 25 °C. En première approximation on pourra donc choisir pour l'été une température de 25 °C et une humidité relative de 60 %, et pour l'hiver une température de 19 ou 20 °C et une humidité relative de 30 % ;
une fois ces valeurs choisies, il devient possible de calculer les charges enthalpiques et hydriques (on se référera aux Guides de l'AICVF ou aux méthodes proposées par le CSTB pour le calcul détaillé des déperditions thermiques d'un bâtiment) ;
la droite de soufflage peut alors être déterminée, en effectuant les bilans appropriés ; dans le diagramme psychrométrique, la droite de soufflage est la droite de pente g qui passe par le point représentatif de l'ambiance désirée. Chacun des points de cette droite correspond à un débit de soufflage différent ; le choix de ce débit dépend de différents facteurs, comme par exemple l'écart de température maximal admissible pour éviter tout désagrément (généralement de 6 à 12 °C selon la technique employée), ou le taux de brassage requis (généralement compris entre 3 et 20 volumes/heure) pour assurer une bonne homogénéité sans faire de courants d'air ;
une fois le point de soufflage déterminé, il reste à choisir un traitement d'air permettant d'amener un mélange d'air extérieur et d'air intérieur dans cet état. Le taux de recirculation de l'air dépend des contraintes d'hygiène. Plus il est important, plus la dépense énergétique le sera aussi. Les exemples qui suivent montrent comment les traitements élémentaires peuvent être combinés pour former une gaine de traitement d'air convenable. On notera qu'en première approximation le ventilateur réchauffe d'environ 1 °C l'air véhiculé. En hiver cela se traduit par un moindre besoin de chauffage, et en été par un besoin de refroidissement plus important.
Exemples de cycles
Il existe de nombreux cycles de climatisation possibles. Nous nous contentons ici de présenter deux exemples correspondant à des installations typiques de refroidissement d'été et de chauffage hivernal.
Explorations dirigées
Cette exploration vous guide dans vos premiers pas d'utilisation de Thermoptim pour étudier un cycle de climatisation d'un aéroport, situé dans un endroit chaud et humide.
Cette exploration vous guide dans vos premiers pas d'utilisation de Thermoptim pour étudier un cycle de climatisation d'une banque, située dans un endroit froid et humide.
Connaissances acquises
Grâce à ce programme, à la fin du module, vous :
connaîtrez les définitions des grandeurs utilisées pour caractériser les mélanges humides et les principales relations entre elles
saurez utiliser les diagrammes de Carrier et de Mollier pour les gaz humides
connaîtrez les principes de calcul des principales transformations humides
aurez étudié des cycles de climatisation des ambiances d'été et d'hiver
