Production d'hydrogène, reformage du méthane, électrolyse
Sixième module
Nous étudions dans ce module la production d'hydrogène à grande échelle, en développant deux technologies pouvant être associées à des réacteurs nucléaires , le reformage du méthane et l' électrolyse à haute température.
Le volume horaire est d'environ 2 h 30 de travail.
Thème 1 : Procédés de production d'hydrogène
L'hydrogène peut être utilisé comme carburant propre pour les transports ou pour la production d'électricité.
Pour en produire à grande échelle à partir d'un réacteur nucléaire, divers procédés peuvent être utilisés, dont voici les principaux :
Le reformage du méthane : ce procédé utilise la chaleur produite par le réacteur nucléaire pour convertir le méthane (CH4) en hydrogène et en dioxyde de carbone (CO2). Le reformage peut être réalisé par vapeur d'eau (Steam Methane Reforming ou SMR en anglais), par oxydation partielle (POX) ou par reformage autotherme (ATR).
L'électrolyse de l'eau : dans ce procédé, l'électricité générée par le réacteur nucléaire est utilisée pour décomposer l'eau en hydrogène et en oxygène. L'électrolyse peut être réalisée à haute température (HTE) ou à basse température (BTE).
La pyrolyse du méthane : dans ce procédé, la chaleur issue du réacteur nucléaire permet de décomposer le méthane en hydrogène et en carbone solide.
La gazéification du charbon : la chaleur nucléaire sert à convertir le charbon en hydrogène et en monoxyde de carbone (CO).
Les procédés thermochimiques : ils utilisent la chaleur d'origine nucléaire pour décomposer l'eau en hydrogène et en oxygène. Il existe plusieurs procédés thermochimiques, tels que le cycle soufre-iode, le cycle cuivre-chlore et le cycle hybride soufre.
Chacun de ces cycles présente des avantages et des inconvénients en termes d'efficacité, de coût, de sécurité et de complexité. Le choix du cycle dépend souvent des caractéristiques spécifiques du réacteur nucléaire, des ressources disponibles et des exigences du marché pour l'hydrogène produit.
Dans ce qui suit, nous nous contentons de quelques développements relatifs aux deux premiers procédés, étant entendu que les modèles de reformage du méthane sont relativement complexes et que ce thème peut donc être considéré comme optionnel dans le cadre de ce cours.
Thème 2 : Reformage du méthane
Il est possible de produire de l'hydrogène à partir d'un autre combustible. Cette opération est appelée reformage.
On peut distinguer 5 principales techniques de reformage :
le vapocraquage
l'oxydation partielle
le reformage autothermal
le craquage thermique
le plasma
Vapocraquage
Le vapocraquage catalytique est un procédé endothermique qui permet de transformer la molécule d'hydrocarbure en CO, CO2 et H2, en la faisant réagir avec de l'eau en quantité suffisante.
D'une manière générale l'équation du vapocraquage du combustible CnHm s'écrit :
CnHm + n H2O --> n CO + (n + m/2) H2
Le vapocraquage des hydrocarbures légers prend place à une température de 700 à 1000 °C, en présence de catalyseurs à base de nickel. La charge doit préalablement avoir été désulfurée.
Le gaz de synthèse produit contient du monoxyde de carbone qui doit ensuite être converti, comme nous le verrons plus loin, par une réaction dite de shift.
Oxydation partielle
L'oxydation partielle est une réaction exothermique qui se déroule en phase gazeuse, avec ou sans catalyseur :
CnHm + n2 O2 --> n CO + m/2 H2 (ΔH <0)
Il s'agit d'une combustion incomplète de l'hydrocarbure à cinétique rapide, hors équilibre.
Reformage autothermal
Le reformage autothermal correspond à la combinaison du vapocraquage et de l'oxydation partielle. De cette manière, la chaleur nécessaire au vapocraquage est apportée par l'oxydation partielle
Il permet d'atteindre des taux de conversion proches de 100 % à 650 °C, mais la réaction est relativement difficile à maîtriser.
Craquage thermique
Le craquage thermique consiste à décomposer la molécule d'hydrocarbure à température élevée (1000 à 2000 °C) selon la réaction
CnHm --> n C + m/2 H2 (ΔH <0)
Elle est elle aussi difficile à contrôler.
Reformage par plasma
Le reformage par plasma est un craquage de la molécule d'hydrocarbure réalisée en présence d'un arc électrique à une température voisine de 2000 °C.
Conversion du CO en CO2
Dans les trois premières techniques de reformage que nous avons citées, les produits de la réaction contiennent du monoxyde de carbone, qu'il peut être nécessaire d'éliminer.
La réaction du gaz à l'eau (water gas shift en anglais) est souvent employée pour convertir le CO en CO2
CO2 + H2 <--> CO + H2O (ΔHv = 41 kJ/mol)
C'est une réaction catalytique effectuée dans un ou plusieurs réacteurs, de cinétique lente, fortement influencée par la température. Elle permet généralement de convertir l'essentiel du CO.
Reformage du méthane
Dans ce qui suit, nous nous limitons à l'étude du reformage du méthane sans élimination du monoxyde de carbone.
Le procédé met donc en jeu un vapocraquage, que nous supposons partiel. En effet, en présence d'eau et à haute température, la réaction de dissociation de l'eau doit quelquefois être prise en compte.
L'équation de base du reformage d'un combustible comme le méthane est :
CH4 + H2O --> CO + 3 H2 (ΔH = 206 140 kJ/kmol) (1)
Elle permet de convertir le combustible en hydrogène, mais nécessite de l'eau et un apport de chaleur, et produit du monoxyde de carbone.
Par souci de simplicité, nous supposons dans cet exemple que le gaz naturel ne contient que du méthane, de l'éthane, du gaz carbonique et de l'azote. La prise en compte d'autres composants réactifs ou inertes ne pose pas de problème particulier, si l'on fait l'hypothèse que les autres réactifs réagissent complètement comme l'éthane.
Le reformeur reçoit du gaz naturel humidifié, qui réagit selon les trois réactions :
CH4 + H2O --> CO + 3 H2 (ΔH = 206 140 kJ/kmol) (1)
C2H6 + 2 H2O --> CO + 5 H2 (ΔH = 347 000 kJ/kmol) (2)
CO + H2O <--> CO2 + H2 (ΔH = -41 200 kJ/kmol) (3)
La réaction de l'éthane peut être considérée comme complète, alors que les deux autres sont à l'équilibre, leurs constantes étant données par :
ln(Kp1a) = 31,0152 - 28 357,7/T + 610 573/T2 (4)
ln(Kp2) = -3,57414 + 3 642,48/T + 292 593/T2 (5)
Appelant F° le débit molaire de gaz naturel, x le débit molaire de CO issu de la réaction (1), y le débit molaire de CO2 issu de (3), w/2 le débit molaire de CO issu de la réaction (2), a et d les fractions molaires de CH4 et de CO2 dans le gaz naturel, et SC le nombre de moles de H2O par mole de gaz naturel, on peut écrire :
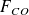 = x + 2w – y
= x + 2w – y
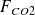 = y + d.F°
= y + d.F°
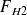 = 3x + 5w + y
= 3x + 5w + y
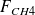 = a.F° – x
= a.F° – x
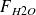 = SC.F° - x –2w –y
= SC.F° - x –2w –y
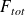 = (1+SC).F° + 2x + 4w
= (1+SC).F° + 2x + 4w
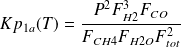 (6)
(6)
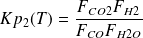 (7)
(7)
Avec :
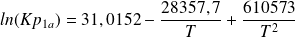
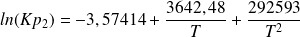
Les deux équations d'équilibre (6) et (7) forment un système non linéaire difficile à résoudre. On peut cependant remarquer que celle de la réaction (7) est une forme quadratique en x et y, qui permet d'exprimer formellement l'une de ces deux variables par rapport à l'autre comme solution d'une équation du second degré.
Si l'on exprime x en fonction de y de cette manière et que l'on réinjecte la valeur obtenue dans l'autre équation, on obtient une formulation implicite en y, qui peut être résolue numériquement plus facilement. Une seule des deux solutions de l'équation du second degré doit être retenue, et l'équation en y ne possède qu'une solution positive réelle. L'intervalle de recherche de sa valeur n'est cependant pas évident à trouver, notamment du fait de l'existence d'une singularité dans la fonction, correspondant à l'annulation de FCH4.
x étant fonction croissante de y, une solution consiste à chercher une borne supérieure ymax de l'intervalle en résolvant l'équation y = f(a.F°) solution de (7). La borne inférieure peut être choisie proportionnelle à ymax : ymin = 0.9 ymax. La solution de (6) est alors facilement obtenue par dichotomie entre ces deux bornes.
Le modèle que l'on peut retenir est dans ces conditions le suivant :
la composition des espèces est donnée par la résolution des équations ci-dessus : à partir des débits molaires de combustible humidifié en entrée, on détermine les compositions et débits molaires des différentes espèces en sortie, le seul paramètre à prendre en compte étant la température du réacteur ;
la chaleur nécessaire à la réaction peut alors être calculée et imposée par un thermocoupleur ;
cette chaleur est fournie par une chambre de combustion située directement en amont du thermocoupleur.
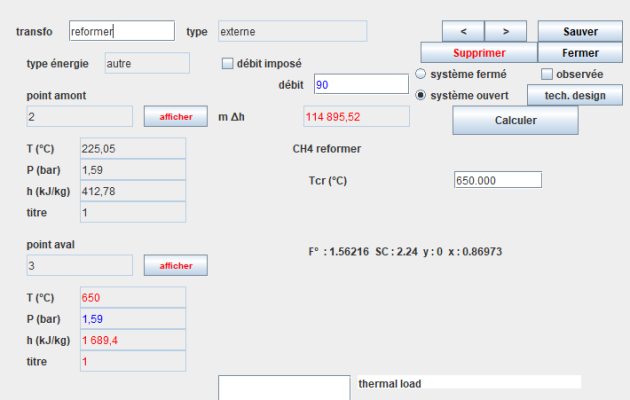
Dans Thermoptim, le reformeur est représenté par une transfo externe connectée à un thermocoupleur. La classe s'appelle Reformer.
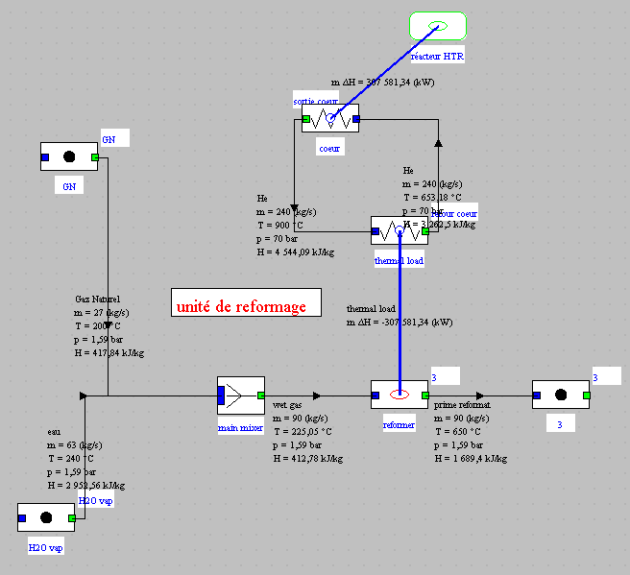
Le reformeur est ainsi composé d'une chambre de réaction, d'une source de chaleur et de deux échangeurs, l'un servant à vaporiser l'eau nécessaire au reformage, et l'autre à préchauffer le mélange avant la réaction.
Dans le modèle, comme le montre la figure, on suppose que la chambre de réaction est chauffée par l'intermédiaire d'un thermocoupleur.
Sur ce schéma, la source de chaleur est un réacteur nucléaire HTR de 300 MW refroidi par de l'hélium. En bas de l'écran, à gauche, du gaz naturel et de l'eau vaporisée sont mélangés avant d'entrer dans la chambre de réaction, où ils sont transformés en reformat primaire, la chaleur de réaction étant fournie par le réacteur nucléaire.
L'écran du composant reformeur est donné par la figure ci-dessous.
Les débits d'entrée sont déterminés par les composants placés en amont de cette transfo et de la source de chaleur. Comme ils sont exprimés en unités massiques, le débit molaire F°, la valeur de SC et les valeurs de x et y sont affichés sur l'écran de la transfo. Le champ donnant accès au thermocoupleur apparaît en bas à droite. Le seul paramètre est la température du réacteur.
La puissance thermique apportée par le thermocoupleur est déterminée par la transfo.
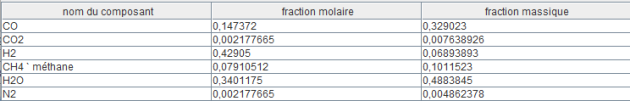
La composition du reformat est donnée dans la figure ci-dessous. La fraction molaire d'hydrogène est égale à 42,9 %, et sa fraction massique à 6,89 %.
Dans cet exemple, la production d'hydrogène est donc de 6,2 kg/s. La puissance thermique fournie par le réacteur nucléaire étant de 307,6 MW, la consommation d'énergie par kg d'hydrogène produit est de 49,6 MJ.
Thème 3 : Principe de l'électrolyse
L'électrolyse est un procédé ancien et bien connu : un électrolyseur réalise une réaction électrochimique qui permet de produire de l'hydrogène et de l'oxygène à partir d'eau grâce à une consommation d'électricité, selon la réaction endothermique :
H2O --> H2 + 1/2 O2
Un électrolyseur est composé de deux électrodes, l'anode et la cathode, séparées par un électrolyte.
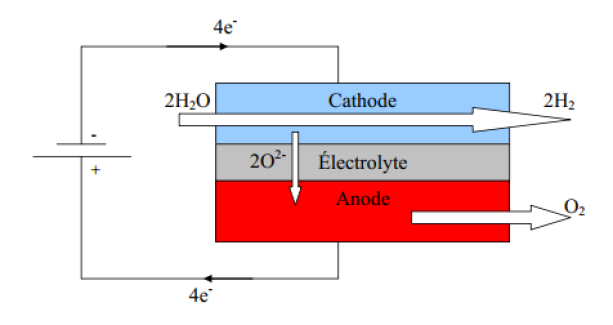
L'eau entre au niveau de la cathode où se produit une réduction électrochimique induite par le champ électrique régnant dans la cellule :
H2O + 2 e- --> H2 + O2-
A l'anode, les ions O2- sont oxydés en oxygène et libèrent des électrons :
2 O2- --> O2 + 4 e-
Le schéma d'une unité élémentaire ou Simple Repeat Unit (SRU) est donné ci-dessous.
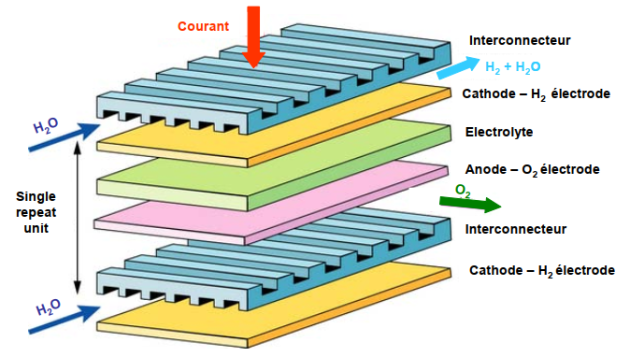
Une unité élémentaire d'électrolyse est constituée en associant une cellule et deux demi-interconnecteurs. L'unité suivante se situe en dessous de la précédente, permettant une intégration d'ensemble.
Texte à trous
Ce texte à trous vous permettra de vérifier votre compréhension du fonctionnement des électrolyseurs.
Thème 4 : Électrolyse de l'eau à haute température
L'électrolyse de l'eau à haute température (HTE) est un procédé qui utilise de l'électricité pour décomposer l'eau en hydrogène et en oxygène à des températures élevées, généralement comprises entre 800 et 1000°C.
Le principe de l'électrolyse HTE est similaire à celui de l'électrolyse à basse température (BTE), mais il présente plusieurs avantages. Tout d'abord, la haute température réduit la quantité d'énergie électrique nécessaire pour décomposer l'eau, ce qui rend le procédé plus efficace sur le plan énergétique. En outre, la chaleur produite par le réacteur nucléaire peut être utilisée directement pour chauffer l'eau, ce qui réduit les coûts de production.
Le procédé d'électrolyse HTE utilise généralement des électrolytes solides, tels que des oxydes cériums ou des zirconates, qui sont stables à haute température. Les électrodes sont souvent fabriquées à partir de matériaux réfractaires tels que le nickel ou le cobalt.
Cependant, l'électrolyse HTE est encore en phase de développement et n'est pas encore largement utilisée à l'échelle industrielle. Des recherches sont en cours pour améliorer l'efficacité énergétique du procédé et réduire les coûts de production.
Les électrolyseurs sont actuellement utilisés pour produire de l'hydrogène pur pour un certain nombre d'industries telles que l'électronique, la pharmacie et l'alimentation. Ils sont cependant chers car ils nécessitent de l'électricité. L'électrolyse produit également de l'oxygène gazeux commercialement précieux qui a de nombreuses applications industrielles. Les technologies varient selon la température de fonctionnement et l'électrolyte.
Le procédé alcalin a été développé en premier et est la méthode la plus mûre de production d'hydrogène, avec l'inconvénient d'avoir de mauvaises performances en raison d'une faible efficacité de conversion et d'une consommation d'énergie élevée.
Récemment, la recherche et le développement se sont concentrés sur les cellules à membrane électrolyte polymère (PEM) utilisant un électrolyte polymère solide qui est plus compact et offre une efficacité et une densité de courant plus élevées.
Cependant, à basse température, les performances des électrolyseurs sont assez faibles en raison des barrières thermodynamiques.
La production d'hydrogène par électrolyse à haute température apparaît donc comme une voie prometteuse, si bien que de nombreuses recherches sont en cours sur ce sujet, notamment sur les électrolyseurs à cellule d'électrolyse à oxyde solide (SOEC), basés sur la technologie des conducteurs ioniques à oxyde solide, telle que celle utilisée pour les piles à combustible à oxyde solide (SOFC).
Thème 5 : Modélisation d'un électrolyseur à haute température
A la sortie de l'électrolyseur, l'hydrogène mélangé à de la vapeur d'eau est collecté. La séparation ne pose pas de problème particulier : il suffit de condenser l'eau pour obtenir de l'hydrogène pur.
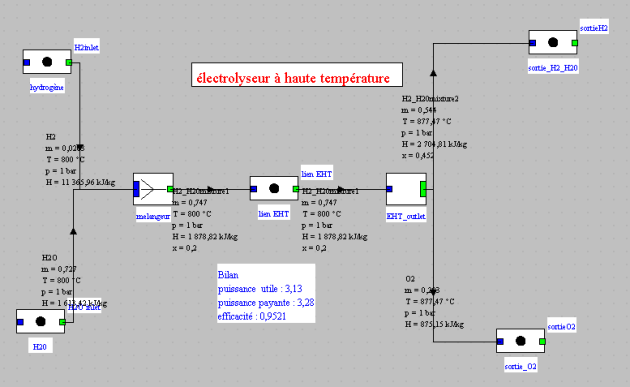
Un électrolyseur haute température reçoit un mélange de vapeur d'eau et d'hydrogène (de composition molaire typiquement 80% - 20%) à 30 bar et 800 °C. Il en sort deux fluides : l'oxygène et le mélange initial enrichi en hydrogène.
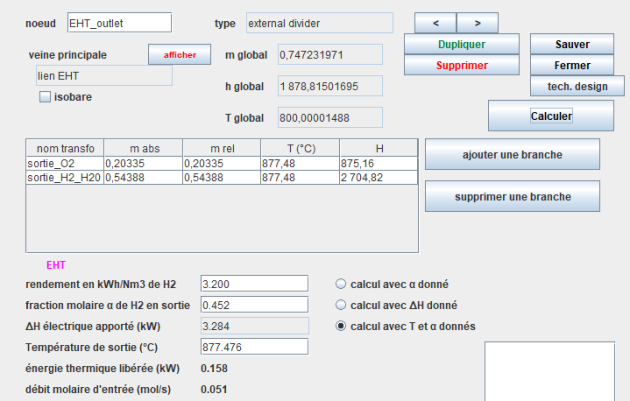
Le modèle Thermoptim comporte un mélangeur classique en amont servant à créer le mélange ([H2], [H2O]) à l'entrée de l'électrolyseur, et un diviseur externe en aval, les deux étant reliés par une transfo-point. La structure du modèle est donnée figure ci-dessus et l'écran de l'électrolyseur figure ci-dessous.
Notez que, bien que les corps mis en jeu soient des gaz, on a fait apparaître l'équivalent d'un titre dans l'affichage du point "sortie_H2", de valeur 0,452. Il représente la fraction molaire d'hydrogène dans le mélange ([H2], [H2O]) en sortie de l'électrolyseur.
De la même manière, la fraction molaire d'hydrogène dans le mélange ([H2], [H2O]) en entrée de l'électrolyseur est affichée dans l'état du point "lien EHT" (ici 0,2).
Le modèle que nous présentons est particulièrement simple : il prend en compte comme paramètres la fraction molaire d'hydrogène en sortie α ou l'électricité fournie ΔH, et le « rendement » R1 en kWh/Nm3, qui exprime la quantité d'électricité à fournir pour électrolyser 1 Nm3 d'hydrogène.
Le bilan des espèces est facile à établir. L'électricité apportée sert à électrolyser l'eau et à produire de l'hydrogène et de l'oxygène, et est convertie pour partie en chaleur qui élève la température de l'appareil.
Trois modes de calcul sont possibles :
soit déterminer ΔH connaissant α et le rendement en kWh/Nm3 ;
soit déterminer α en se donnant ΔH et le rendement en kWh/Nm3 ;
soit déterminer le rendement R1 en se donnant α et la température de sortie.
Dans le premier mode, le calcul se fait de la manière suivante : le modèle détermine la fraction molaire d'entrée et le débit molaire d'entrée à partir de la veine principale du diviseur externe, en déduit le débit molaire d'hydrogène à électrolyser, et établit ses bilans.
Appelons β la fraction molaire d'entrée en hydrogène, et m·mol le débit molaire total en entrée.
Le débit molaire d'hydrogène électrolysé m·H2 est :
m·H2 = (α – β) m·mol
La composition du mélange ([H2], [H2O]) étant connue, sa masse molaire peut être déterminée. Comme son débit molaire est égal au débit molaire d'entrée, son débit massique est connu.
Le débit molaire d'oxygène est m·H2/2 . Son débit massique s'en déduit directement.
Le « rendement » en kWh/Nm3 permet de calculer la quantité d'électricité ΔH à fournir par :
ΔH = m·H2 MH2 3600/(1000 . 0,08988), MH2 étant la masse molaire de l'hydrogène.
ΔH0 étant la chaleur de réaction théorique (246 kJ/mol), la chaleur libérée vaut :
Q = ΔH – m·mol ΔH0,
Dans le second mode, l'enchaînement des calculs est légèrement modifié : connaissant ΔH, m·H2 peut être déterminé. On en déduit α. Q est déterminé de la même manière.
Dans le troisième mode, Q est déterminé à partir de la température de sortie. α étant connu, m·H2 s'en déduit, ainsi que ΔH, et le rendement peut être calculé.
L'énergie payante prise en compte pour l'électrolyseur est (ΔH), et l'énergie utile (ΔH-Q).
Avec les paramétrages ci-dessus (0,9 kmol/s d'hydrogène et 3,6 kmol/s d'eau à l'entrée de l'électrolyseur), les compositions gazeuses obtenues sont données dans les figures ci-dessous.
Comme nous allons le voir, ce modèle peut être utilisé pour représenter un électrolyseur intégré dans un système, et notamment pour étudier l'intégration thermique du procédé, afin de minimiser l'apport de chaleur externe.
Ce modèle mériterait d'être affiné mais nous ne le faisons pas ici car un tel travail sortirait des limites de ce cours.
Tout d'abord, il ne prend pas en compte la décroissance en fonction de la température de l'énergie électrique nécessaire à la réaction, alors qu'elle est l'une des principales raisons pour lesquelles on cherche à opérer à haute température.
Ensuite, la valeur théorique minimale du rendement d'un électrolyseur à haute température dépend de la réaction chimique qui se produit pendant l'électrolyse de l'eau. Dans des conditions idéales, la décomposition de l'eau en hydrogène et en oxygène nécessite une quantité d'énergie électrique, qui est déterminée par la tension thermodynamique minimale requise pour la réaction.
Cette tension minimale, appelée tension de décomposition de l'eau, est égale à 1,23 volts à une température de 25 °C et à une pression de 1 atm. À cette tension minimale, l'efficacité théorique maximale de l'électrolyse de l'eau est d'environ 83 %, ce qui correspond à un rendement minimal d'environ 4,5 kWh/Nm3 d'hydrogène produit.
Cependant, dans la pratique, les électrolyseurs à haute température fonctionnent généralement à des tensions plus élevées que la tension de décomposition de l'eau pour surmonter les pertes d'énergie liées à la résistance électrique, à la polarisation des électrodes et à d'autres facteurs. Par conséquent, la valeur théorique minimale du rendement d'un électrolyseur à haute température est généralement inférieure à la valeur pratique minimale.
Couplage à un réacteur nucléaire d'un électrolyseur à haute température
Comme nous l'avons indiqué, la chaleur nécessaire à la vaporisation de l'eau entrant dans l'électrolyseur peut être fournie par différentes sources, et notamment par des réacteurs nucléaires.
Pour des raisons diverses, dont de sûreté, la plupart des projets à l'étude envisagent de prélever de la vapeur dans le cycle secondaire du réacteur électrogène, le transformant en installation de cogénération nucléaire.
Un exemple sera donné dans le septième module qui traite précisément de cogénération.
Connaissances acquises
Grâce à ce programme, à la fin du module, vous :
aurez compris l'intérêt des réacteurs nucléaires pour la production d'hydrogène à grande échelle
aurez analysé les mécanismes mis en œuvre dans le reformage du méthane et la manière dont ils peuvent être modélisés
aurez étudié un modèle simple d'électrolyseur à haute température