Combustions
Cette séance traite de la thermodynamique des combustions.
Dans les chambres de combustion fonctionnant en système ouvert, on fait généralement l’hypothèse que la pression de sortie est égale à la pression d’entrée. Si l’on veut affiner l’analyse, on peut considérer qu’il y a une petite baisse de pression due aux “pertes de charge”, mais elle peut être négligée en première approximation.
Il en résulte que l’évolution de référence est l’isobare.
Les chaudières et les chambres de combustion dans lesquels les combustions prennent place étant fixes, le travail utile mis en jeu est nul. Par ailleurs, à l’entrée et à la sortie de ces composants, les vitesses des fluides sont toujours relativement faibles, de telle sorte que les énergies cinétiques sont négligeables.
Dans ces conditions l’écriture du premier principe se résume pour les chambres de combustion à : Δh = Q
Calculer la chaleur mise en jeu dans ces composants consistera donc à déterminer la variation d’enthalpie du fluide qui les traverse.
Référence cours :
- “Composants technologiques / Combustion”
- tome 1, ch. 4.6
Pour suivre la présentation, passez à l’étape suivante.
(Séance réalisée le 22/02/05 par Renaud Gicquel)THERMODYNAMIQUE DE LA COMBUSTION
Composition de l’air
| Composant | fraction molaire % |
masse molaire kg/kmole |
fraction massique % |
|---|---|---|---|
| N2 | 0,781 | 28 | 0,756 |
| Ar + CO2 | 0,009 | 40 | 0,012 |
| O2 | 0,210 | 32 | 0,232 |
| N2 atmosph. | 0,790 | 28,15 | 0,768 |
THERMODYNAMIQUE DE LA COMBUSTION
- Stœchiométrique
- conduit à la température de fin de combustion la plus élevée
THERMODYNAMIQUE DE LA COMBUSTION
- Non stœchiométrique
- excès d’air : e
- facteur d’air : λ = 1 + e
- richesse : R = 1 / λ
-
λ > 1
THERMODYNAMIQUE DE LA COMBUSTION
Combustions incomplètes
THERMODYNAMIQUE DE LA COMBUSTION
- Dissociation du CO2
-
CO2 + H2 ↔ CO + H2O
THERMODYNAMIQUE DE LA COMBUSTION
-
Dissociation du CO2
- température de figeage :
- température à laquelle calculer Kp pour trouver la bonne composition des gaz brûlés
SRC d’une combustion (calcul de T)
- analyser les compositions du combustible et du comburant
- fixer λ, Tfigeage et le taux dissociation du CO2
- déterminer la composition des produits
- calculer la chaleur de réaction mise en jeu
- calculer la température de fin de combustion
THERMODYNAMIQUE DE LA COMBUSTION
- Pouvoirs calorifiques supérieur et inférieur
- pouvoir calorifique supérieur (PCS) : eau à l’état liquide (condensée)
- pouvoir calorifique inférieur (PCI) : eau à l’état gazeux
THERMODYNAMIQUE DE LA COMBUSTION
- Enthalpies de réaction
- ν1 A1 + ν2 A2 ↔ ν3 A3 + ν4 A4
-
(4.6.30)
-
hf enthalpies de formation (1 bar, 25 °C)
- (nulles pour les corps purs)
-
- ΔHr fonction des νi et donc des xi
Variation de la chaleur de réaction en cas de défaut d’air
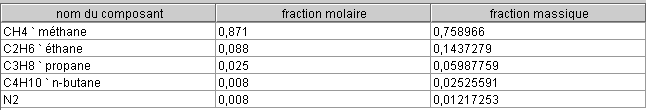
Calculons à titre d’exemple la chaleur de réaction de l’octane pour une réaction stœchiométrique :
C8H18 + 12,5 O2 + 3,76 x 12,5 N2 → 8 CO2 + 9 H2O + 3,76 x 12,5 N2
- ΔHr = hfC8H18 + 12,5 hfO2 - 8 hfCO2 - 9 hfH2O
- ΔHr = - 208450 + 0 - 8 (-393520) - 9 (-285830) = 5 512 180 kJ/kmole
La masse molaire de l’octane étant 114,22 kg/kmole, sa chaleur de réaction massique est égale à :
- Qp = 48 259 kJ/kg
Si la réaction n’est plus stœchiométrique, mais se déroule en défaut d’air, la formation de monoxyde de carbone vient diminuer la chaleur de réaction.
Pour une richesse égale à 1,25, par exemple, la réaction devient :
C8H18 + 10 O2 + 37,6 N2 → 3 CO2 + 5 CO + 9 H2O + 37,6 N2
- ΔHr = hfC8H18 + 10 hfO2 - 3 hfCO2- 5 hfCO - 9 hfH2O
- ΔHr = - 208450 + 0 - 3 (-393520) - 5 (- 110530)- 9 (-285830) = 4 097 230 kJ/kmole
soit une baisse de 25,7 % par rapport à la réaction stœchiométrique.
THERMODYNAMIQUE DE LA COMBUSTION
- Température de fin de combustion
- adiabatique de flamme
-
équation de base :
- la chaleur libérée par la combustion sert à échauffer les produits de la réaction
- maximale à la stœchiométrie
- fonction du facteur d’air λ
- calcul assez complexe
THERMODYNAMIQUE DE LA COMBUSTION
Température adiabatique de flamme
THERMODYNAMIQUE DE LA COMBUSTION
- Calcul des combustions dans Thermoptim
- soit sous forme CHa (il faut donner a et hf pour la formulation CHa)
- soit comme gaz composé de la base (les formules chimiques sont décodées)
Combustion 
Combustions
Cette séance traite de la thermodynamique des combustions.
Elle a permis de montrer les points suivants :
- la combustion de référence est stœchiométrique
- le facteur d’air lambda caractérise l’écart par rapport à la stœchiométrie
- la prise en compte des imbrûlés peut se faire en considérant la dissociation du CO2
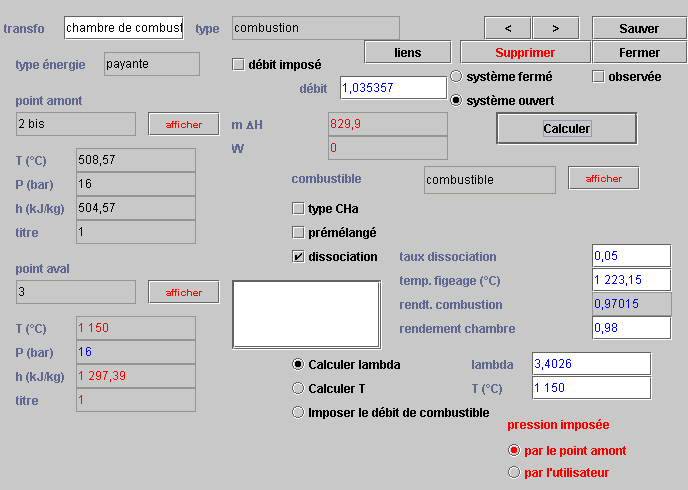
Paramétrage de la transfo combustion
Le paramétrage de cette transfo étant un peu plus complexe que celui des autres, nous vous suggérons de vous reporter à la documentation de Thermoptim pour des explications complémentaires.
Le document téléchargeable ci-dessous reprend les indications fournies oralement avec l’écran précédent.