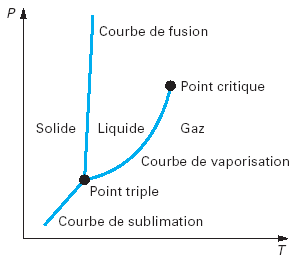
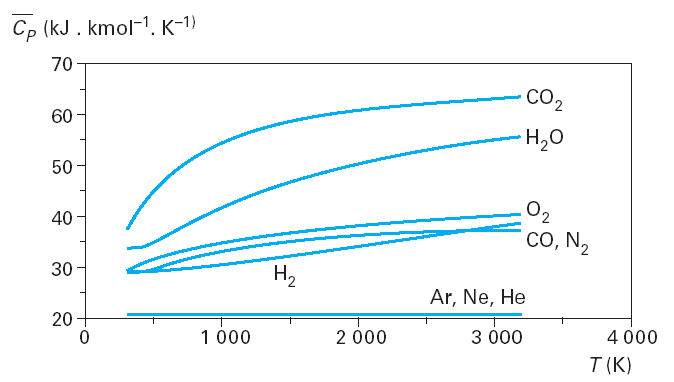
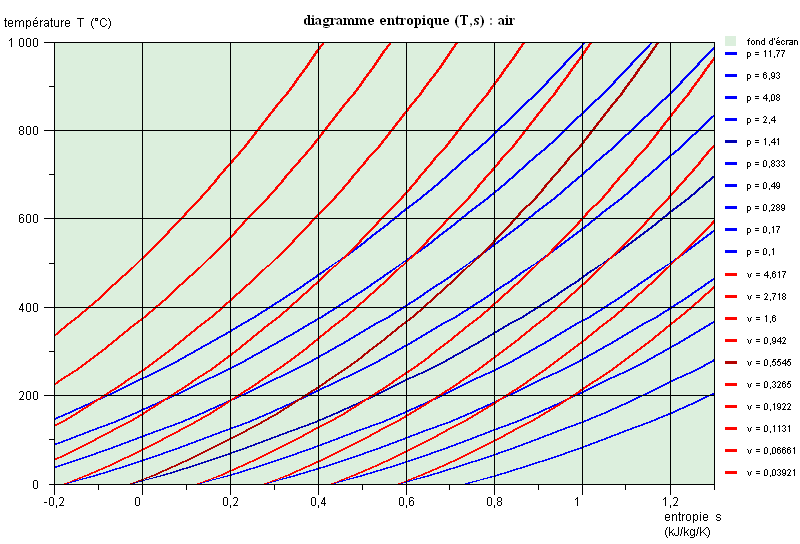
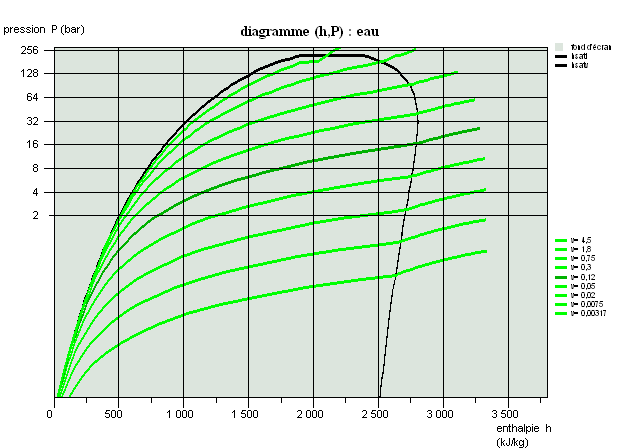
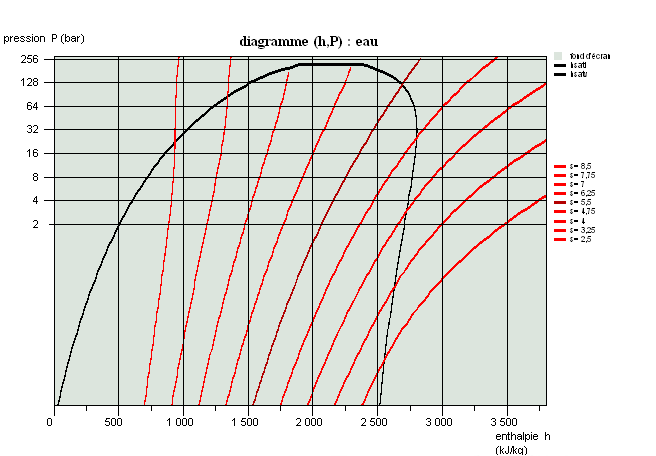
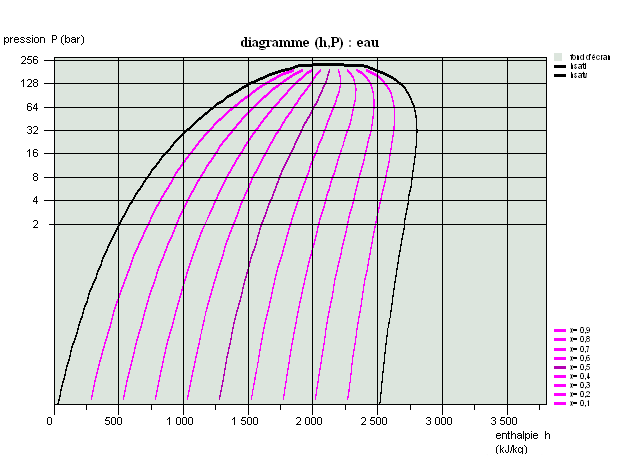
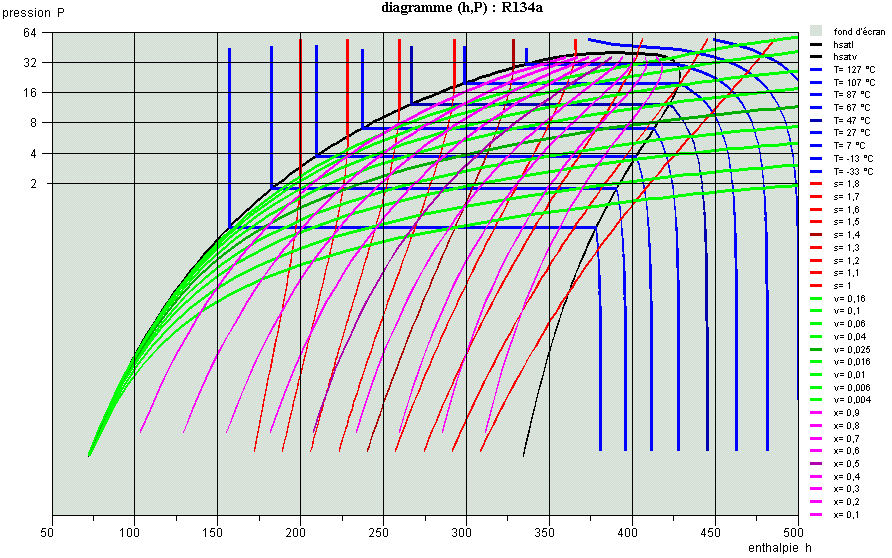
Propriétés des corps, diagrammes usuels
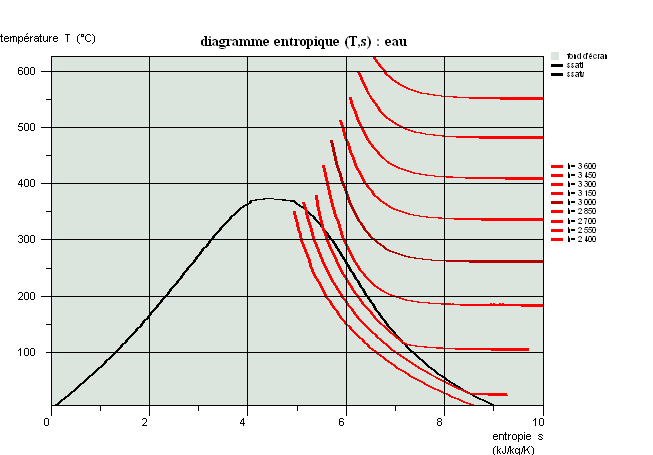
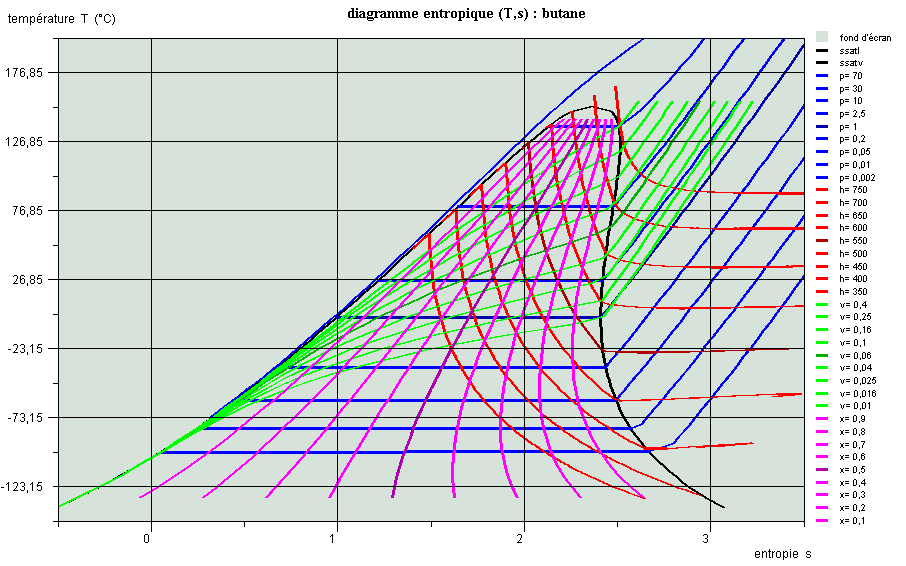
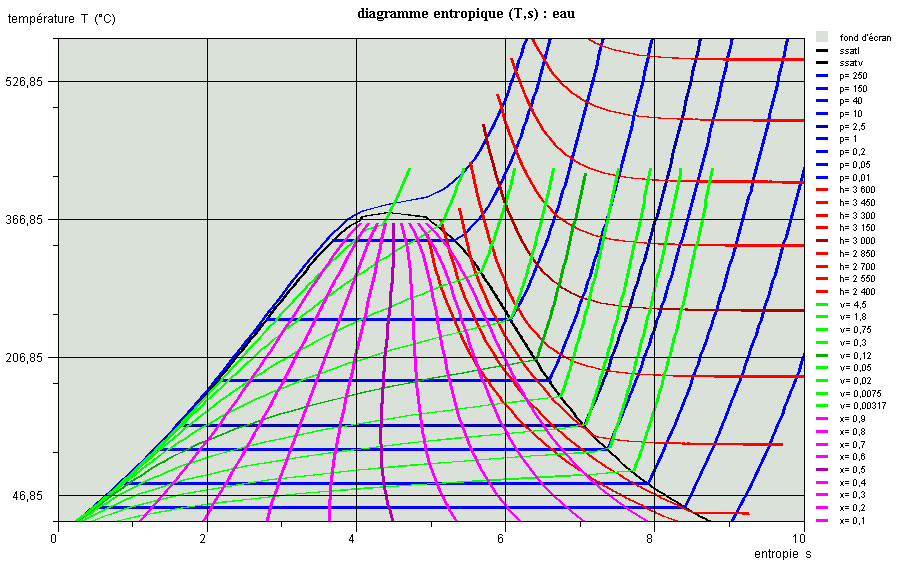
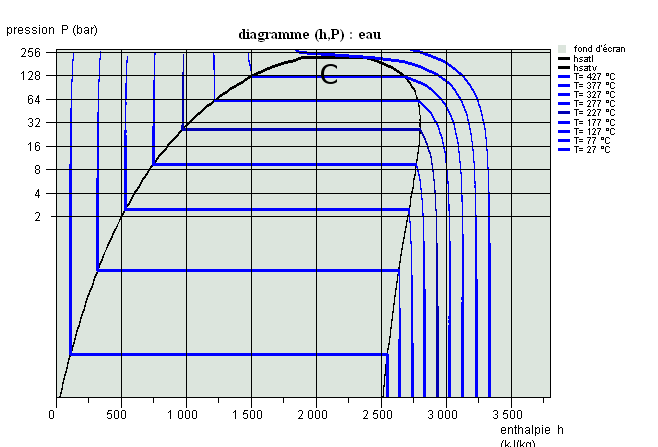
Cette séance est une introduction aux propriétés des corps et présente succinctement les diagrammes usuels (entropique et des frigoristes).
Quelques indications sur le calcul des fluides réels, et notamment sur les propriétés d’un mélange de phases en équilibre liquide-vapeur sont aussi données.
Le premier des liens ci-dessous vous donne accès à un extrait long du manuel présentant les propriétés des corps, auquel nous vous conseillons de vous référer.
Pour plus de précisions sur ces sujets, vous pouvez vous reporter à deux articles des Techniques de l’Ingénieur :
Diagrammes thermodynamiques : généralités, article BE 8 040, par Renaud GICQUEL
Diagrammes thermodynamiques : fluides purs, azéotropes et gaz idéaux, article BE 8 041, par Renaud GICQUEL
Référence cours :
- “Bases de Thermodynamique / Représentation des propriétés des corps”
Pour suivre la présentation, passez à l’étape suivante.
(Séance réalisée le 27/12/06 par Renaud Gicquel)