Notions fondamentales et approche qualitative des principes
Introduction
Cette page s'adresse avant tout aux utilisateurs de ce portail qui ne sont pas des professionnels de la thermodynamique mais qui ont besoin d'acquérir une culture minimale de cette discipline pour étudier des machines thermiques.
Beaucoup ont déjà "fait un peu de thermo", mais le plus souvent il y a longtemps ou bien de manière assez abstraite, sans savoir comment la mettre en application, et ils n'ont généralement ni le besoin ni le temps de s'investir suffisamment dans la discipline pour en maîtriser toutes les difficultés.
Pour des raisons diverses, souvent professionnelles, ils cherchent à comprendre comment fonctionnent certaines technologies énergétiques ou machines thermiques réalisant la conversion entre différentes formes d'énergie et permettant par exemple de produire soit de l'énergie mécanique à partir de chaleur, soit du froid à partir d'énergie mécanique.
L'objectif de cette page est de leur faciliter la tâche en présentant de manière aussi simple que possible les notions fondamentales qu'il leur faudra employer.
Nous commencerons par faire quelques rappels sur les machines thermiques et ce que l'on appelle les cycles thermodynamiques qu'elles mettent en oeuvre, puis nous préciserons la notion de température[1], avant de distinguer les deux principaux modes d'échange d'énergie réalisés dans ces machines. Nous pourrons alors présenter le premier principe de la thermodynamique, et montrer ses implications quant aux principales évolutions subies par les fluides dans les machines thermiques.
Nous analyserons ensuite les limites du premier principe et introduirons la notion d'irréversibilité, avant de revenir sur les transferts de chaleur et présenter le deuxième principe.
Enfin, nous vous fournirons des liens vers les ressources du portail relatives aux propriétés des fluides.
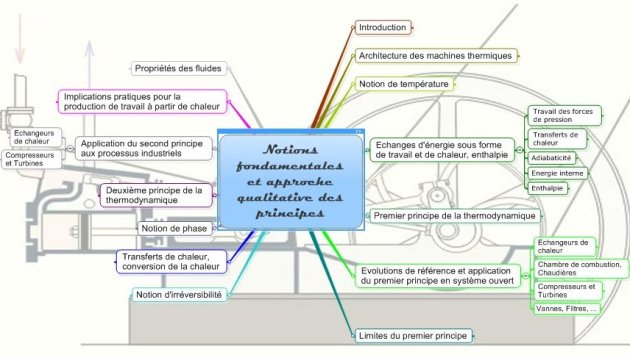
La carte ci-dessous, établie par A. Lambotte, résume l'essentiel des notions fondamentales qui seront abordées ici
Architecture des machines thermiques
Les machines thermiques (moteurs, machines frigorifiques...) sont dans la plupart des cas constituées par assemblage d'un petit nombre de composants assurant des fonctions élémentaires comme des échanges de chaleur, des compressions ou détentes... C'est à ce titre que l'on peut les qualifier de systèmes énergétiques.
Ces composants sont traversés par des fluides qui sont le plus souvent à l'état gazeux ou liquide.
Les technologies énergétiques se présentent ainsi comme des assemblages de composants traversés par des fluides thermodynamiques qui y subissent des transformations de complexité variable. Dans certains cas, comme par exemple dans un moteur alternatif diesel ou à essence, le même organe (ensemble cylindre et piston) est amené à jouer successivement le rôle de compresseur, de chambre de combustion puis d'organe de détente.
L'analyse du fonctionnement des machines thermiques repose donc sur celle de leurs composants, qui ne peut être faite qu'en étudiant les échanges d'énergie qui y prennent place, comme nous le verrons dans la section suivante. Avant d'aborder cette question, il est toutefois nécessaire d'introduire une nouvelle notion qui joue un rôle fondamental en thermodynamique, celle de système ouvert ou fermé[2].
Nous venons d'utiliser le même terme, celui de système, sous deux sens différents, dont il importe de bien comprendre la distinction. C'est une difficulté incontournable, qui provient de ce que :
l'usage courant a consacré le sens de système pour qualifier un ensemble d'éléments interagissant entre eux ;
alors qu'en thermodynamique, un système désigne une quantité de matière isolable de son environnement par une frontière fictive ou réelle.
Plus précisément, un système thermodynamique est dit fermé s'il n'échange pas de matière avec l'extérieur à travers ses frontières ; sinon il est dit ouvert.
Les débutants sont souvent décontenancés par la distinction entre systèmes fermés et systèmes ouverts, ces derniers correspondant à un concept nouveau pour eux car au cours de leur scolarité de premier cycle, ils n'ont généralement étudié que des systèmes fermés (pour éviter la prise en compte des échanges de matière aux frontières).
Dans un moteur diesel ou à essence, les soupapes sont fermées pendant la compression, la combustion et la détente, isolant de l'extérieur la masse de gaz qui se trouve comprise entre le piston, la chemise et la culasse. Les transformations qui prennent place à l'intérieur du moteur doivent donc être calculées en système fermé[2]. Dans le cas d'une turbine à gaz , compresseur, chambre de combustion et turbine sont parcourus par un flux continu de gaz. A l'entrée et à la sortie de chacun de ces composants, de la matière est transférée. Les transformations doivent alors être calculées en système ouvert[2].
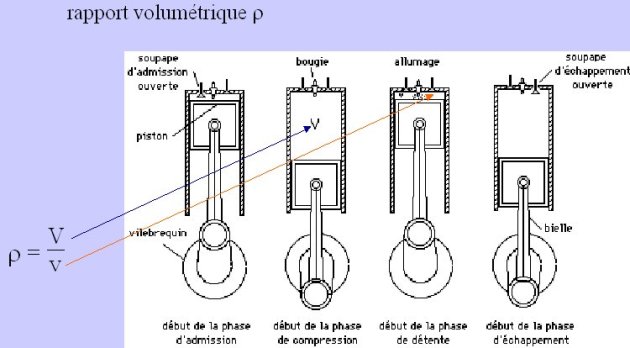
Le cas des moteurs alternatifs à combustion interne est illustré par la figure ci-dessus, qui représente un moteur à essence à quatre temps dont deux des caractéristiques géométriques principales sont la cylindrée V et le rapport volumétrique ro.
Comme le montre la figure, pendant les phases d'admission et d'échappement, de la matière entre ou sort de l'ensemble (culasse, cylindre, piston), de telle sorte que cet ensemble doit être modélisé comme un système ouvert[2]. En revanche, pendant les phases de compression et de combustion-détente, les soupapes sont fermées et cet ensemble doit être considéré comme un système fermé[2].
Comme la pression varie très fortement au cours de la transformation, il est même préférable, si l'on veut approcher un peu la réalité, de décomposer la combustion en plusieurs étapes : par exemple d'abord à volume constant, puis à pression constante, et enfin à température constante.
Il y a un certain paradoxe dans le fait que les calculs sont généralement plus faciles à effectuer pour les systèmes ouverts que pour les systèmes fermés, bien que ces derniers ne mettent pas en jeu d'échanges de matière avec l'extérieur. La raison en est que la pression est généralement connue dans les calculs en système ouvert[2] alors qu'elle dépend de nombreux facteurs dans un système fermé[2].
A titre d'exemple, la combustion dans une turbine à gaz (système ouvert) prend place à pression constante, à de faibles pertes de charge près, alors que dans un moteur diesel ou à essence (système fermé), la pression varie très fortement au cours de la transformation, de telle sorte qu'il est préférable, si l'on veut approcher un peu la réalité, de la décomposer en plusieurs étapes : par exemple d'abord à volume constant, puis à pression constante, et enfin à température constante.
Pour achever de compliquer les choses, il est naturel (mais fatal) de confondre les notions d'ouverture et de fermeture des systèmes au sens thermodynamique que nous venons d'introduire et au sens du cycle complet que parcourent les fluides d'une machine thermique.
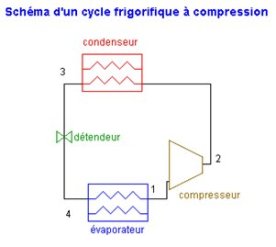
Par exemple un cycle de machine frigorifique à compression est globalement fermé (figure ci-dessous), faute de quoi le frigorigène serait perdu dans l'atmosphère, ce qui serait à la fois coûteux et préjudiciable à l'environnement, alors que chacun de ses composants pris séparément (à l'exception éventuellement du compresseur s'il est volumétrique) constitue un système ouvert, traversé en régime permanent par un certain débit de fluide frigorigène.
La machine opère ainsi selon un cycle fermé associant plusieurs composants travaillant chacun en système ouvert.
Nous avons à plusieurs reprises évoqué ci-dessus la notion de cycle, qui mérite d'être précisée. Dans de nombreuses applications pratiques, comme dans l'exemple qui vient d'être présenté, le fluide subit une série de transformations qui l'amènent à se retrouver dans son état[3] initial, ce qui justifie que l'on parle de cycle.
Dans certains cas (moteurs à combustion interne) les gaz d'échappement sont rejetés dans l'atmosphère, aussi est-il impropre de parler de cycle. Cependant, dans une approche simplifiée de ces transformations, on suppose que les propriétés thermodynamiques du fluide sortant sont les mêmes que celles du fluide entrant, et on peut alors considérer que le fluide parcourt un cycle partiel, dit cycle ouvert, qu'il est possible de fermer par une évolution fictive complémentaire, ce qui permet alors de le comparer à d'autres cycles fermés. Par extension, on en vient à parler de cycle pour qualifier la représentation de la succession des évolutions thermodynamiques subies par le ou les fluides mis en jeu dans une technologie énergétique.
On a coutume de distinguer deux grandes catégories de cycles :
les cycles moteurs permettent de produire de l'énergie mécanique à partir de chaleur ;
dans les cycles récepteurs (ou encore générateurs ou inverses), on apporte de l'énergie mécanique et on s'en sert pour remonter le niveau thermique d'une quantité de chaleur ou produire du froid.
Dans la quasi-totalité des cycles moteurs, le fluide thermodynamique est successivement comprimé, puis chauffé, et enfin détendu. Si le cycle est ouvert, le fluide est alors évacué dans l'environnement externe ; s'il est fermé, il est refroidi, puis de nouveau comprimé.
Dans les cycles récepteurs, le fonctionnement est inversé : le fluide thermodynamique est d'abord comprimé, puis refroidi, et enfin détendu. Si le cycle est ouvert, le fluide est alors évacué dans l'environnement externe ; s'il est fermé, il est chauffé, puis de nouveau comprimé. Dans la machine frigorifique que nous avons présentée ci-dessus, le chauffage du fluide est assuré grâce à l'évaporateur, par refroidissement de l'enceinte froide.
Notion de température
La notion de température peut être introduite de plusieurs manières différentes. Nous commencerons ici par une définition simple et opérationnelle, qui repose sur les deux propositions suivantes :
on sait construire un thermomètre, appareil dont toutes les propriétés physiques sont, dans des conditions opératoires bien définies, fonction d'une seule variable, appelée température ;
on sait réaliser des milieux matériels tels que, lorsqu'un thermomètre y est plongé, son indication reste constante dans le temps et indépendante de son orientation et de la place qu'il occupe dans le milieu.
On pose alors que la température du milieu est égale à celle du thermomètre, et on dit que le milieu est en équilibre thermique.
A partir de cette présentation, il est possible de faire le lien avec les définitions axiomatiques de la température[1] déduites par exemple du deuxième principe. Un exposé rigoureux et complet de cette notion ne s'impose cependant pas, d'autant qu'elle est assez intuitive et que son utilisation pratique ne pose généralement pas de problème particulier.
Une autre manière courante d'introduire la température est basée sur la thermodynamique statistique, qui permet d'établir que la température d'un gaz est la grandeur macroscopique représentative de l'état d'agitation thermique de ses molécules. On sait que celles-ci se déplacent de manière aléatoire dans le gaz, générant ce que l'on appelle le mouvement brownien.
Du fait de ce mouvement, les molécules possèdent une énergie cinétique microscopique liée à la température, ce qui explique que celle-ci dépende de leur vitesse et par conséquent de leur agitation thermique.
Notez bien que la température peut être définie de plusieurs manières, selon le zéro et l'échelle choisis. Usuellement, on l'exprime généralement en degrés Celsius (°C), dont le zéro correspond au point triple de l'eau. Une température t (°C) est égale à T- 273,15, T étant la température absolue exprimée en Kelvin (K).
Dans les calculs de thermodynamique, sauf indication contraire, T est la température absolue exprimée en Kelvin.
Attention : il faut prendre bien garde à ne pas confondre température et chaleur, qui sont deux notions très différentes, la seconde représentant une quantité d'énergie, comme nous le verrons ci-dessous.
Echanges d'énergie sous forme de travail et de chaleur, enthalpie
Au cours des transformations qu'ils subissent dans les composants des machines thermiques, les fluides qui les traversent échangent de l'énergie avec l'extérieur ou entre eux, principalement sous deux formes : mécanique, notée traditionnellement W en système fermé (et
 en système ouvert comme nous le verrons plus loin), et thermique notée Q.
en système ouvert comme nous le verrons plus loin), et thermique notée Q.
D'autres formes d'énergie existent bien entendu, comme l'électricité ou l'énergie mise en oeuvre dans une réaction chimique, mais elles n'interviennent que dans des cas particuliers.
TRAVAIL DES FORCES DE PRESSION
Considérons un système fermé de volume élémentaire. Les forces extérieures qui s'exercent sur lui se limitent généralement d'une part à l'action de la pesanteur sur la masse fluide, et d'autre part aux pressions qui s'exercent sur ses frontières.
Dans les machines thermiques, le travail de la pesanteur est dans la majorité des cas négligeable devant celui des actions dites "de contact". Pour fixer les idées, le travail fourni par une masse de 1 kg d'eau tombant d'une hauteur de 100 m est égal à 980 J, alors que celui de la même masse de vapeur d'eau détendue de manière isentropique de 100 bar et 500 °C à 1 bar est égal à 983 kJ, soit 1000 fois plus important.
En conséquence, dans les machines thermiques, le travail des forces massiques sera le plus souvent négligeable devant celui de la pression.
On peut facilement montrer que le travail des forces de pression sur un système fermé de volume élémentaire dV a pour valeur
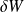 = - P dV.
= - P dV.
Cette expression très importante n'est valable que si le système reste en équilibre statique[4], c'est-à-dire si les hypothèses ci-dessous sont vérifiées :
la pression reste uniforme dans le système ;
le fluide reste au repos.
On remarquera que la formule ci-dessus implique que le travail reçu par le système est positif, et que le travail qu'il cède est négatif. Par convention, on généralise ce résultat en comptant positivement l'énergie reçue par un système, et négativement celle qu'il fournit à l'extérieur.
TRANSFERTS DE CHALEUR
Soit une masse fluide simple, à l'intérieur de laquelle il ne se produit pas de frottements. Soit
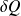 la quantité de chaleur échangée avec l'extérieur et reçue par l'unité de masse de ce fluide, au cours d'une transformation infiniment petite.
la quantité de chaleur échangée avec l'extérieur et reçue par l'unité de masse de ce fluide, au cours d'une transformation infiniment petite.
Un fait expérimental essentiel, base de la thermodynamique des fluides compressibles, est que
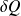 est une forme différentielle de l'état[3] de cette masse fluide, appelée équation calorimétrique.
est une forme différentielle de l'état[3] de cette masse fluide, appelée équation calorimétrique.
A titre d'exemple, dans le cas d'un système monovariant (équilibre entre phases lors d'un changement d'état), l'équation calorimétrique ne dépend que du titre x, rapport de la masse de vapeur à la masse totale (vapeur + liquide) dans le cas d'une vaporisation ou d'une condensation :
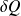 = L dx
= L dx
L étant l'enthalpie de changement d'état.
Pour un gaz parfait, l'équation calorimétrique qui relie
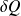 à la température s'exprime, en système fermé et en système ouvert, sous les formes bien connues :
à la température s'exprime, en système fermé et en système ouvert, sous les formes bien connues :
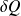 = Cv dT lors d'une transformation à volume constant ;
= Cv dT lors d'une transformation à volume constant ;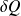 = Cp dT lors d'une transformation à pression constante.
= Cp dT lors d'une transformation à pression constante.
ADIABATICITE
On dit qu'un composant est adiabatique lorsqu'il n'échange pas de chaleur avec l'extérieur. C'est une notion très importante en pratique, car, comme nous le verrons plus loin, elle s'applique à un très grand nombre d'organes de compression et de détente.
ENERGIE INTERNE
La distinction que nous avons effectuée dans la section précédente entre systèmes ouverts et fermés se retrouve lorsqu'il s'agit de caractériser l'énergie contenue ou mise en jeu dans une quantité de matière donnée.
Il est fondamental de savoir que la notion classique d'énergie interne U ne peut être utilisée que pour les systèmes fermés, et qu'elle ne convient pas pour les systèmes ouverts du fait que ceux-ci sont traversés par un ou plusieurs flux de matière.
ENTHALPIE
Pour ces derniers, la généralisation de l'énergie interne s'appelle l'enthalpie H (H = U + PV). Elle diffère de U par le produit PV, parfois appelé "énergie de transvasement", qui est représentatif de la différence d'état du fluide en entrée et en sortie du composant considéré.
Un peu plus loin, après avoir présenté le premier principe, nous effectuerons une petite démonstration qui permet de comprendre d'où provient cette définition de l'enthalpie.
Les débutants ne doivent surtout pas s'inquiéter de cette nouvelle notion : sur le plan pratique, il leur suffit de raisonner en considérant que l'enthalpie représente l'énergie mise en jeu dans un composant fonctionnant en système ouvert, et remplace dans ce contexte l'énergie interne. Une fois cette transposition bien assimilée, le concept d'enthalpie ne présente aucune difficulté particulière.
Reportez-vous à la page du portail consacrée aux échanges d'énergie pour en avoir une présentation plus complète avec les équations associées.
Premier principe de la thermodynamique
Le premier principe, connu aussi sous le nom de principe de l'équivalence ou principe de la conservation de l'énergie, exprime que l'énergie contenue dans un système isolé ou qui évolue selon un cycle fermé reste constante, quelles que soient les transformations qu'il subit.
Les différentes formes que peut prendre l'énergie d'un système : énergie mécanique, énergie calorifique, énergie potentielle, énergie cinétique... sont ainsi toutes équivalentes entre elles au sens du premier principe.
Le premier principe est un principe de conservation analogue à celui de la conservation de la masse d'un système, ou des espèces chimiques lors d'une réaction. Il s'agit donc d'une notion très intuitive et facile à mettre en pratique.
Le premier principe s'écrit sous deux formes selon qu'on l'exprime en système fermé ou ouvert. Dans le premier cas, il fait intervenir l'énergie interne, et dans le second l'enthalpie. En système fermé, il s'écrit selon l'équation bien connue ci-dessous, qui peut aussi servir de définition de l'énergie interne :
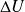 +
+
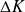 = W + Q
= W + Q
Reportez-vous à la page du portail consacrée au premier principe pour en avoir une présentation plus complète avec les équations associées.
Les opérations industrielles se déroulent généralement en continu, chaque composant (turbine, pompe, vanne...) recevant et évacuant de la matière en permanence. Lorsque, comme c'est souvent le cas, leurs conditions de fonctionnement sont stabilisées, éventuellement de manière périodique, on parle de "régime permanent" ou de "régime stationnaire".
Considérons ainsi une machine cyclique fonctionnant en système ouvert, schématisée par la figure ci-dessous.
On peut supposer que cette machine fonctionne entre deux enceintes de grandes dimensions, où le fluide est en équilibre. Les états amont (1) et aval (2) sont définis par leurs pressions et leurs températures supposées uniformes malgré les prélèvements et les apports dus à l'aspiration et au refoulement. Par exemple, un compresseur de turbine à gaz aspire dans l'atmosphère et refoule dans la chambre de combustion où règne une pression sensiblement uniforme.
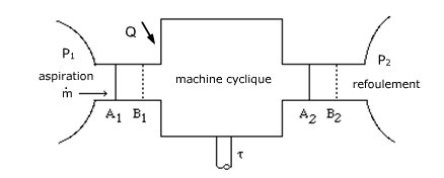
Nous allons maintenant établir la forme enthalpique du premier principe en faisant un raisonnement très simple, qui consiste à suivre l'évolution d'un volume de contrôle fermé, et à calculer le travail des forces externes sur l'ensemble de ses frontières, en distinguant les sections de passage des fluides, les parois fixes, qui bien évidemment ne produisent ni ne reçoivent aucun travail, celui-ci étant est le produit (scalaire) d'une force par un déplacement, et les parois mobiles, au niveau desquelles s'exerce un certain travail
 que l'on appelle travail utile[5].
que l'on appelle travail utile[5].
Dans son passage de (1) à (2), chaque unité de masse de fluide reçoit, de la part des parois mobiles, le travail utile
 , dont la connaissance est fondamentale, puisque son produit par le débit-masse m donne la puissance mise en jeu (aux pertes mécaniques près dans les paliers et organes de transmission).
, dont la connaissance est fondamentale, puisque son produit par le débit-masse m donne la puissance mise en jeu (aux pertes mécaniques près dans les paliers et organes de transmission).
On peut facilement démontrer que, par unité de masse, un composant réalisant une transformation quelconque fournit un travail
 algébriquement égal au travail WA des forces de pression calculées en système fermé, augmenté du travail de transvasement, c'est-à-dire de la variation du produit Pv.
algébriquement égal au travail WA des forces de pression calculées en système fermé, augmenté du travail de transvasement, c'est-à-dire de la variation du produit Pv.
La machine, traversée par un débit m, fonctionne en régime non permanent, mais périodique, c'est-à-dire que l'ensemble de ses composants, y compris la masse fluide qui s'y trouve, se retrouve périodiquement dans le même état[3] (on notera que le régime permanent se déduit du régime périodique en faisant tendre vers 0 la période considérée).
Considérons le système fermé constitué de la masse fluide comprise à l'état initial dans le volume de contrôle limité par les parois fixes et mobiles et par les sections A1 et A2 situées respectivement dans les enceintes d'entrée et de sortie.
Au bout d'une période dt, ce volume de contrôle s'est déplacé et est maintenant limité par les sections B1 et B2, supposées elles aussi dans les enceintes d'entrée et de sortie. La machine a été traversée par la masse m dt de fluide, masse commune des tranches A1B1 et A2B2 (conservation du débit-masse), et a exercé sur le fluide le travail
 m dt (par définition).
m dt (par définition).
Le travail des forces externes W m dt est égal à la somme du travail de la pesanteur (négligeable comme nous l'avons vu) et des travaux des forces de pression exercées sur les différentes frontières de la machine, au nombre de quatre : A1, A2, les parois mobiles et les parois fixes.
Sur ces dernières,
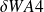 = 0.
= 0.
Sur A1 :
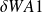 = - P1 dV1 = - P1 (-m dt) v1 = P1 v1 m dt
= - P1 dV1 = - P1 (-m dt) v1 = P1 v1 m dt
Sur A2, de la même manière,
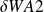 = - P2v2 m dt
= - P2v2 m dt
Par définition, le travail utile[5] est celui des forces de pression sur les parois mobiles,
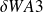 =
=
 m dt
m dt
On a donc :
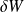 =
=
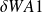 +
+
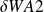 +
+
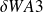 +
+
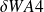
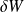 = WA dt = P1 v1 m dt - P2v2 m dt +
= WA dt = P1 v1 m dt - P2v2 m dt +
 m dt
m dt
 = WA + P2v2 - P1v1 = WA +
= WA + P2v2 - P1v1 = WA +
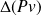
Rappelons l'équation donnant le premier principe en système fermé :
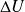 +
+
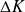 = WA + Q
= WA + Q
En ajoutant à ses deux membres
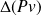
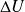 +
+
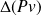 +
+
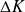 = WA +
= WA +
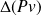 + Q =
+ Q =
 + Q
+ Q
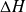 +
+
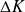 =
=
 + Q
+ Q
Cette petite démonstration permet de comprendre d'où provient l'équation qui relie l'enthalpie à l'énergie interne. Le terme
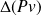 représente l'écart entre le travail utile[5] mis en oeuvre au niveau des parois mobiles de la machine et celui de l'ensemble des forces de pression sur les frontières de cette dernière.
représente l'écart entre le travail utile[5] mis en oeuvre au niveau des parois mobiles de la machine et celui de l'ensemble des forces de pression sur les frontières de cette dernière.
Cette notion de travail utile est loin d'être triviale. Sur le plan pratique cependant, elle ne pose pas de problème particulier : dans toutes les compressions et détentes en système ouvert, c'est le travail utile qui devra être considéré dans les calculs.
Evolutions de référence et application du premier principe en système ouvert
L'expression (enthalpique) du premier principe pour un composant traversé par un fluide est donnée ci-dessous, les notations étant celles du livre Systèmes Energétiques.
C étant la vitesse du fluide, le premier principe appliqué à un composant traversé par un débit unitaire de fluide s'exprime, en unités massiques, sous la forme :
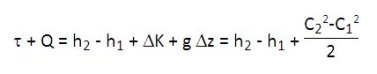
Pour la plupart des machines thermiques, le terme
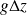 est négligeable. Dans de nombreux cas, la variation d'énergie cinétique
est négligeable. Dans de nombreux cas, la variation d'énergie cinétique
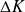 reste faible vis à vis des autres variations (sauf bien entendu dans des cas spéciaux tels que les réacteurs d'avion, certains aubages de turbomachines ou organes de détente).
reste faible vis à vis des autres variations (sauf bien entendu dans des cas spéciaux tels que les réacteurs d'avion, certains aubages de turbomachines ou organes de détente).
Dans ces conditions, la somme du travail reçu ou fourni et de la chaleur échangée avec l'extérieur par le composant est égale à la variation d'enthalpie du fluide qui le traverse.
Cette relation fondamentale explique pourquoi, dans les appareils industriels, il est pratiquement impossible de mettre en oeuvre à la fois une forte puissance mécanique et un flux calorifique important.
Pour le calcul des transformations, les implications de ce constat sont très importantes en pratique puisqu'elles indiquent que dans la plupart des composants des machines industrielles, les échanges thermiques et mécaniques sont découplés. Elles expliquent aussi pourquoi l'enthalpie est une fonction d'état[6] très utilisée dans les transformations en système ouvert : la variation d'enthalpie du fluide correspond selon les cas à l'énergie mécanique ou thermique mise en jeu.
ECHANGEURS DE CHALEUR
Les composants appelés à transférer de la chaleur d'un fluide à un autre nécessitent de grandes surfaces d'échange, les flux thermiques leur étant proportionnels. Des considérations techniques et économiques amènent à adopter des dispositifs purement statiques. Par exemple, de grands faisceaux de tubes en parallèle, parcourus intérieurement par un fluide pendant que l'autre circule à l'extérieur.
 est alors nul en raison de l'absence de parois mobiles.
est alors nul en raison de l'absence de parois mobiles.
Par ailleurs, en première approximation, ces échangeurs peuvent être supposés isobares.
Dans un échangeur de chaleur, la chaleur Q cédée ou fournie par un fluide à l'autre est égale à sa variation d'enthalpie
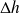 .
.
CHAMBRES DE COMBUSTION, CHAUDIERES
Le même raisonnement s'applique aux chambres de combustion ou aux chaudières, qui peuvent généralement être considérées comme isobares.
Dans une chambre de combustion ou une chaudière, la chaleur Q cédée au fluide qui la traverse est égale à sa variation d'enthalpie
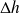 .
.
COMPRESSEURS ET TURBINES
Les machines réalisant la compression ou la détente d'un fluide ont une conception très compacte pour des raisons de poids, d'encombrement et de coût. Pour les mêmes raisons, elles tournent très vite (plusieurs milliers de tours par minute). Chaque parcelle de fluide y séjourne très peu de temps.
Par ailleurs les coefficients d'échange thermique des gaz ont des valeurs faibles.
Les courts temps de séjour, les petites surfaces de contact fluide-paroi, et les faibles coefficients d'échange font que l'échange de chaleur est minime et que le fonctionnement de ces machines est pratiquement adiabatique[7] (Q = 0).
Dans une machine adiabatique de compression ou détente, le travail utile
 est égal à la variation d'enthalpie du fluide
est égal à la variation d'enthalpie du fluide
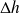 .
.
VANNES, FILTRES
Il existe une classe d'appareils où
 et Q sont nuls tous les deux : ce sont les détendeurs statiques tels que vannes, filtres... La transformation correspondante s'appelle un "laminage" isenthalpique.
et Q sont nuls tous les deux : ce sont les détendeurs statiques tels que vannes, filtres... La transformation correspondante s'appelle un "laminage" isenthalpique.
Un laminage conserve l'enthalpie (
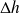 = 0).
= 0).
Limites du premier principe
La principale limite du premier principe de la thermodynamique est l'absence de prise en compte de la qualité de l'énergie : il y a certes équivalence entre les différentes formes d'énergie exprimées en kWh, mais les possibilités de convertir une forme d'énergie en une autre ne sont pas du tout équivalentes.
Ainsi, le travail peut toujours être intégralement converti en chaleur, mais la réciproque n'est pas du tout vraie.
Le travail correspond ainsi à l'une des formes d'énergie dont la qualité est la meilleure, et peut donc constituer une référence.
Nous pouvons reformuler ceci en disant qu'un indicateur possible de la qualité de l'énergie est sa capacité à être convertie en travail.
A titre d'exemple, on peut convertir de l'électricité en travail en utilisant un moteur électrique de rendement supérieur à 98 %, ou bien réciproquement convertir un travail mécanique en électricité grâce à un alternateur de rendement équivalent, ce qui signifie que ces deux formes d'énergie sont de même qualité.
Notion d'irréversibilité
Dans l'exemple de conversion électricité-travail que nous venons de donner, nous avons indiqué que les machines utilisées avaient d'excellents rendements, proches de 1, mais légèrement inférieurs à cette valeur : l'expérience montre en effet que, quelles que soient les précautions prises, une partie de l'énergie est dégradée. Le premier principe nous apprend que la totalité de l'énergie est bien conservée, mais une partie voit sa qualité diminuer et se retrouve in fine sous forme de chaleur, du fait des frottements, pertes par effet Joule...
On nomme irréversibilités ces pertes, du fait que la transformation travail --> électricité --> travail n'est pas totalement réversible : une partie du travail initial se retrouve converti en chaleur.
Tranferts de chaleur, conversion de la chaleur
Dans le cas particulier de la chaleur, on constate expérimentalement, et ceci est toujours vérifié, sans aucune exception, que le transfert de chaleur entre deux milieux à températures différentes se fait toujours du milieu le plus chaud (celui dont la température est la plus élevée), vers le milieu le plus froid (celui dont la température est la plus basse).
On constate aussi qu'un système hétérogène composé de deux milieux à des températures différentes non isolés l'un de l'autre évolue toujours vers un état[3] homogène à température intermédiaire.
Par ailleurs, lorsque l'on cherche à convertir de la chaleur en travail, l'expérience prouve qu'il faut tout d'abord disposer de deux sources de chaleur, l'une à haute température, et l'autre à basse température.
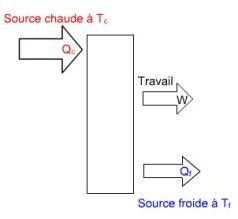
De surcroît, plus l'écart de température entre les sources est important, plus grande est la quantité de travail qui peut être convertie à partir d'un kWh de chaleur.
La température apparaît ainsi elle aussi comme un indicateur possible de la qualité de la chaleur.
Une remarque complémentaire peut être faite à ce stade : c'est bien l'existence d'une différence de température entre deux milieux qui permet d'envisager la production de travail.
Notion de phase
On appelle phase[8] un milieu continu jouissant des trois propriétés suivantes :
il est homogène (ce qui implique une température uniforme) ;
la vitesse en chacun de ses points est nulle dans un repère convenable ;
il n'est soumis à aucune force extérieure à distance (pression uniforme).
Comme on le sait, la matière se présente sous trois phases : solide, liquide et gazeuse. Un système thermodynamique peut être constitué d'un seul corps pur, ou en comporter plusieurs. Dans ce dernier cas, le mélange est caractérisé par sa composition, molaire ou massique. Chacun des constituants du mélange peut se trouver présent sous une ou plusieurs phases. Si les constituants et leurs phases sont répartis uniformément dans le volume délimité par les frontières du système, le mélange est homogène, sinon il est hétérogène. Les propriétés d'un mélange dépendent bien évidemment de son homogénéité.
Deuxième principe de la thermodynamique
Les considérations qui viennent d'être exposées ont historiquement progressivement conduit à l'énonciation du second principe de la thermodynamique et à l'introduction d'une grandeur appelée entropie, qui peut être interprétée de nombreuses manières, en particulier comme la fonction d'état[6] la plus simple faisant apparaître les échanges de chaleur d'un système avec son environnement.
Son principal intérêt sur le plan pratique est de faciliter les calculs qu'il faut effectuer lorsque l'on veut prendre proprement en compte la qualité de l'énergie dans l'étude des conversions entre différentes formes. Elle permet en particulier de quantifier précisément les irréversibilités qui prennent place dans les machines thermiques.
Le second principe peut s'énoncer de la manière suivante : à toute phase[8] sont attachées deux grandeurs T et s, dénommées respectivement "température thermodynamique" et entropie, jouissant des propriétés suivantes :
T est une fonction de la température seule, indépendante du système considéré ;
s est une fonction des variables d'état du système ;
dans toute transformation élémentaire mettant en jeu un échange de chaleur dQ avec l'extérieur, on a dQ <= Tds, l'égalité étant vérifiée si et seulement si la transformation est parfaite (non irréversible).
Le second principe stipule ainsi que toute transformation réelle s'effectue avec création d'entropie.
Il peut aussi s'exprimer de la manière suivante : toute transformation d'un système thermodynamique s'effectue avec augmentation de l'entropie globale incluant l'entropie du système et celle du milieu extérieur. On dit alors qu'il y a création d'entropie.
Le second principe est dû à S. Carnot, qui a démontré en 1824 que le rendement
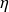 d'une machine thermique idéale décrite par un cycle vaut :
d'une machine thermique idéale décrite par un cycle vaut :
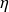 = 1 - Tf/Tc, Tc et Tf étant les températures absolues des sources chaude et froide avec laquelle la machine échange de la chaleur.
= 1 - Tf/Tc, Tc et Tf étant les températures absolues des sources chaude et froide avec laquelle la machine échange de la chaleur.
Carnot a ainsi prouvé que ce rendement ne dépend ni de la nature de la machine ni des fluides utilisés pour la faire fonctionner, mais uniquement de Tc et Tf.
Reportez-vous à la page du portail consacrée au deuxième principe pour en avoir une présentation plus complète avec les équations associées.
Application du second principe aux processus industriels
ECHANGEURS DE CHALEUR
Dans un échangeur, pour que la chaleur puisse être transférée entre les deux fluides, il doit en pratique exister entre eux une certaine différence de température. En effet, pour des raisons tant techniques qu'économiques, les surfaces d'échange entre ces fluides sont nécessairement de dimension finie. Il est alors possible de montrer que l'échange de chaleur s'accompagne d'une augmentation d'entropie.
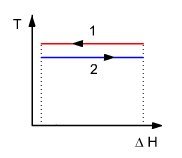
Pour simplifier les calculs, nous nous intéresserons à un échangeur de chaleur entre un fluide chaud 1 qui se condense et un fluide froid 2 qui se vaporise (figure ci-dessus), ce qui permet de considérer que les deux fluides restent chacun à la même température T1 et T2.
Pour un tel échangeur, on peut montrer que la création d'entropie est donnée par la relation suivante, Q étant la quantité de chaleur échangée :
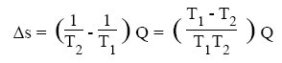
Plus l'écart de température entre les fluides est importante, plus la création d'entropie l'est. Dans un échangeur de chaleur, il y a bien conservation de l'énergie (l'enthalpie) cédée par le fluide chaud au fluide froid, mais le transfert se faisant avec baisse de la température, il y a création d'entropie.
COMPRESSEURS ET TURBINES
Nous avons indiqué ci-dessus que les organes de compression et de détente sont généralement adiabatiques (dQ = 0). Par définition du second principe, dQ = 0 <= Tds, l'égalité étant vérifiée si et seulement si la transformation est parfaite (non irréversible).
Dans un compresseur ou une turbine adiabatique parfait, il n'y a pas de création d'entropie. On dit que l'évolution est isentropique, notion très importante en pratique car il s'agit de la transformation de référence par rapport à laquelle sont caractérisées les évolutions réelles.
Implications pour la production de travail à partir de chaleur
Les deux premiers principes ont de nombreuses implications lorsque l'on cherche à produire du travail à partir de chaleur. Nous nous limiterons ici à en présenter quelques unes.
Tout d'abord, il faut impérativement disposer de deux sources de chaleur, l'une à haute température Tc, et l'autre à basse température Tf. La source chaude cède une puissance calorifique Qc à la machine thermique, qui en convertit une partie P sous forme de puissance mécanique, et rejette Qf à la source froide.
Deuxièmement, en vertu du premier principe, Qf = Qc - P. On appelle rendement ou efficacité de la machine le rapport
 = P/Qc.
= P/Qc.
Plus Tf est élevé, plus epsilon peut l'être, sachant, d'après le second principe, que
 ne peut être qu'inférieur au rendement de Carnot défini plus haut,
ne peut être qu'inférieur au rendement de Carnot défini plus haut,
 = 1 - Tf/Tc.
= 1 - Tf/Tc.
En pratique,
 est souvent très inférieur au rendement de Carnot
est souvent très inférieur au rendement de Carnot
 , du fait que de nombreuses irréversibilités existent dans la machine thermique.
, du fait que de nombreuses irréversibilités existent dans la machine thermique.
Une autre implication pratique de ce que nous venons de voir est donc qu'il faut chercher à réduire le plus possible les irréversibilités. Nous vous renvoyons à la page du portail consacrée aux analyses qualitatives des cycles pour avoir davantage d'explications sur ce sujet.
Propriétés des fluides
Si, comme nous l'avons supposé au début de cette page, vous n'êtes pas des spécialistes de la thermodynamique, il est essentiel que vous vous familiarisiez avec les propriétés des fluides qui sont utilisés dans les machines thermiques, et au moins des corps purs.
Nous vous suggérons pour cela deux approches possibles :
vous référer à la page de présentation des propriétés des corps purs ;
étudier les séances Diapason S04 (propriétés des gaz idéaux) et S04a (Propriétés des corps, diagrammes usuels) .