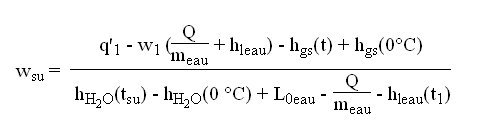Mélanges humides
MÉLANGES HUMIDES
Un certain nombre de gaz utilisés couramment sont des mélanges dont la composition peut varier du fait de la condensation ou de la vaporisation de l'un de leurs composants. En pratique le constituant qui change d'état est le plus souvent l'eau, ce qui justifie qu'une page particulière de ce portail traite des mélanges de gaz et de vapeur d'eau, dénommés ci-après mélanges humides.
L'air sec en particulier ne se rencontre pratiquement jamais : il comprend presque toujours de l'eau, sous forme gazeuse, liquide ou de cristaux de glace. La maîtrise de l'hygrométrie de l'air détermine les conditions de confort des ambiances, ainsi que la conservation des aliments et de nombreux produits. Elle s'obtient grâce à des techniques de climatisation.
Dans cette page, nous nous contenterons de présenter les principes de calcul des propriétés thermodynamiques des mélanges humides. Même s'il est certain que les applications pratiques les plus nombreuses concernent l'air, notre présentation concernera tous les gaz pour lesquels nos hypothèses seront valables, c'est-à-dire à la grande majorité des cas. Par exemple, les propriétés hygrométriques des produits de combustion, qui contiennent presque toujours de l'eau, peuvent être déterminées selon les méthodes présentées ici.
Vous pouvez par ailleurs vous reporter aux séances Diapason ci-dessous relatives aux mélanges humides préparées par le Prof. P. Chantrenne de l'INSA de Lyon. Attention cependant à ce que les notations ne sont pas les mêmes que celles utilisées ici.
TAPAH - Propriétés de l'air humide
TATAH - Transformations de l'air humide
TACLIM - Climatisation
Vous pouvez aussi vous référer au module de formation à distance sur l'air humide réalisé par le Prof. J. Schwartzentruber et ses collègues de l'Ecole des Mines d'Albi, qui traite du sujet comme cas particulier de mélange de gaz réels. Attention cependant à ce que les notations ne sont pas tout à fait les mêmes que celles utilisées ici.
Définitions et conventions
Lorsqu'on s'intéresse à un mélange humide, on a affaire à un mélange de gaz qui ne se condensent pas, que nous appellerons le gaz sec, et d'eau, susceptible de se condenser. Précisons que nous n'étudierons pas ici les brouillards, de telle sorte que nous pourrons supposer que le volume occupé par l'eau éventuellement condensée reste très faible devant celui qu'occupe la phase gazeuse, ce qui nous permettra de le négliger. Dans ces conditions, pour un volume donné, la masse totale de la phase gazeuse peut varier, alors que la masse des constituants incondensables reste toujours constante. C'est pourquoi il est d'usage de rapporter l'ensemble des propriétés thermodynamiques du mélange composant la phase gazeuse à la masse invariante, qui est celle du gaz sec.
Tout se passe en quelque sorte comme si le mélange humide était un mélange de deux corps : le gaz sec, dont la composition est invariable, et l'eau, susceptible de se présenter sous une ou plusieurs phases. Comme on le verra par la suite, il est fondamental pour mener les calculs de bien spécifier à quel corps se rapportent les grandeurs thermodynamiques utilisées, et quelles sont les unités de référence et leur origine. Les notations seront choisies en conséquence.
On appelle humidité spécifique w le rapport de la masse d'eau contenue dans un volume donné de mélange humide à la masse de gaz sec contenue dans ce même volume.
L'eau contenue dans un mélange humide peut être caractérisée de différentes manières : par son humidité spécifique, que nous venons d'introduire, mais aussi plus classiquement par sa fraction molaire ou massique, ou encore par sa pression partielle qui présente ici un intérêt particulier. Tant que la pression partielle de l'eau reste inférieure à sa pression de saturation à la température du gaz, l'eau se présente sous forme de vapeur, sinon elle existe en partie à l'état condensé liquide ou solide. Il existe donc une limite supérieure à la quantité de vapeur d'eau qui peut être contenue dans un mélange humide. Elle dépend de la température et de la pression. Lorsque, à pression donnée, la température descend en dessous de la pression de vapeur saturante de l'eau, la vapeur d'eau commence à se condenser sous forme de brouillard ou sur les parois froides qui délimitent le système s'il en existe.
Compte tenu de son importance pratique, l'état saturé sert de référence, et on appelle humidité relative ε le rapport de la pression partielle de la vapeur d'eau à sa pression de vapeur saturante. Ce rapport est égal à 1 (ou 100 %) lorsque la vapeur commence à se condenser. Sinon, il est inférieur à 1.
On appelle respectivement enthalpie spécifique q' et volume spécifique vspé l'enthalpie et le volume du mélange humide rapportés à 1 kg de gaz sec.
Principes de calcul
On sait qu'un fluide liquéfiable reste assimilable à un gaz idéal jusqu'au voisinage immédiat de l'état liquide lorsque sa pression est très inférieure à sa pression critique. Lorsque ce fluide est un constituant d'un mélange, cette règle s'applique en prenant en compte la pression partielle.
Tant que l'état liquide n'apparaît pas, le mélange se comporte donc comme un gaz idéal. Lorsque la température du mélange s'abaisse au dessous de la température de condensation correspondant à la pression partielle du constituant liquéfiable dans le gaz sec, l'état liquide commence à apparaître. Dans la plupart des cas, bien que ce ne soit pas rigoureusement vrai, on est en droit de considérer que cette phase[1] liquide est pure, formée exclusivement du constituant liquéfiable.
A ce moment, sous réserve que l' équilibre[2] soit établi, l'expérience montre que la situation est la suivante :
la relation d'équilibre liquide-vapeur est vérifiée par le constituant liquéfiable, comme si les autres constituants n'existaient pas. Sa pression partielle, donnée par la loi de pression saturante, vaut donc Pvs = Ps(T) ;
la loi de Dalton s'applique pour le calcul des fonctions thermodynamiques de la phase[1] gazeuse ;
la loi du mélange des phases s'applique pour le calcul des fonctions thermodynamiques de l'ensemble phase[1] liquide - phase[1] gazeuse (on suppose que les tensions interfaciales sont négligeables).
Pour calculer les propriétés thermodynamiques du mélange en présence d'une phase[1] liquide, on procède donc comme suit :
connaissant la température du milieu, on peut déterminer la pression partielle du constituant liquéfiable. On en déduit la somme des pressions partielles (P - Pvs) des autres constituants. Comme on connaît leurs fractions molaires relatives, on peut déterminer complètement la composition de la phase gazeuse, et le nombre de moles du constituant liquéfiable à l'état gazeux. Par différence, on connaît le nombre de moles liquéfiées ;
les lois de Dalton et du mélange des phases permettent ensuite de calculer toutes les propriétés du mélange. Il est évident que, dans ce cas, la composition du mélange évoluant en fonction du titre du constituant liquéfiable, il faut en tenir compte dans le calcul des propriétés thermodynamiques.
Dans Thermoptim le calcul des mélanges humides est effectué selon cette méthode. Il est ainsi possible d’étudier le comportement d’un mélange de vapeur d’eau et d’un gaz de composition quelconque.
Principales relations
Nous utiliserons les indices gs pour qualifier le gaz sec, et gh pour le mélange humide.
Cas où l'on connaît la composition du mélange humide
Par définition de la pression partielle de l'eau :
Pvap = xH2O . P (33)
La masse molaire du gaz sec est :
Mgs = 1/(1 - xH2O)S Minc xinc (34)
inc représentant les divers constituants incondensables
L'humidité spécifique w est alors, par définition :
w = yH2O/ygs = MH2O xH2O / Mgs / xgs (35)
L'humidité relative ε est donnée par les relations suivantes :
si Pvs est la pression de vapeur saturante de l'eau :
Si Pvap < Pvs, ε = Pvap/Pvs
w = MH2O / Mgs . Pvap / (P - Pvap) (36)
Si Pvap > Pvs, ε = 1
w = wsat = MH2O / Mgs . Pvs / (P - Pvs) (37)
Les valeurs du volume et de l'enthalpie spécifique q' peuvent alors être déterminées, cette dernière étant calculée avec un zéro des enthalpies à 0 °C.
Généralement (et c'est le cas dans Thermoptim) l'état de référence, ou zéro, pour le calcul des enthalpies des gaz est pris à la valeur standard de 298 K. Or, les ingénieurs climaticiens ont coutume de choisir comme état de référence 0 °C pour l'air sec, et 0 °C, liquide saturé pour l'eau. Il en résulte un décalage entre les enthalpies des gaz humides telles qu'on les calcule habituellement et celles qui sont représentées sur les diagrammes psychrométriques usuels. Cet écart varie en fonction de l'humidité spécifique.
En pratique, les enthalpies peuvent être rapportées à trois références différentes, qu'il faut savoir bien distinguer sous peine de faire des erreurs. Dans ce qui suit, nous utiliserons selon les cas :
l'enthalpie massique du mélange humide hgh (hgh = 0 à T = 298 K)
l'enthalpie massique du gaz sec hgs (hgs = 0 à T = 298 K)
l'enthalpie spécifique du mélange humide q' (q' = 0 à T = 0 °C, eau liquide)
En général, sauf indications contraires, la première est celle que l'on emploie par défaut, tandis que dans les calculs particuliers aux mélanges humides, c'est généralement la troisième forme qui est utilisée.
Dans ce qui suit, l'indice eau indique que le calcul est effectué avec les équations de l'eau considérée comme un fluide réel, et l'indice H2O qu'il est mené avec les équations de l'eau assimilée à un gaz parfait. hveau est l'enthalpie de l'eau à l'état vapeur, et L0eau représente l'enthalpie de vaporisation de l'eau à 0 °C.
q'(t,w) = hgs(t) - hgs(0°C) + w hveau(t, Pvap) (39)
ou encore, en faisant l'approximation que la vapeur d'eau se comporte comme un gaz idéal :
q'(t,w) = hgs(t) - hgs(0 °C) + w [hH2O(t) - hH2O(0 °C)] + w L0eau (40)
En introduisant hgh, enthalpie du mélange humide (idéal) :
hgh(t) = (hgs + w hH2O(t)) / (1 + w) on obtient :
q'(t,w) = (hgh(t) - hgh(0 °C)) (1 + w) + w L0eau (41)
De même, vspéc = vgh (1 + w)
Dans la zone sursaturée, le gaz est saturé d'eau à l'état vapeur, le reste de l'eau étant à l'état liquide. L'enthalpie spécifique est alors donnée par :
q'(t,w) = hgs(t) - hgs(0°C) + w hveau(t, Pvs)
Cas où l'on connaît la composition du gaz sec
Dans le cas où l'on connaît la composition du gaz sec, les calculs sont menés légèrement différemment, car w est alors une donnée.
On en déduit, Mgs étant la masse molaire du gaz sec :
Pvap = P w Mgs / MH2O /(1 + w Mgs / MH2O) (42)
ε = Pvap/Pvs (43)
Les autres calculs sont menés comme précédemment.
Températures utilisées pour les mélanges humides
L'étude des mélanges humides conduit à introduire plusieurs températures, dont il importe de bien connaître la définition, car, pour un même état du gaz, leurs valeurs peuvent être sensiblement différentes.
On appelle température sèche t (en °C) ou T (en K), ou plus précisément température de bulbe sec la température indiquée par un thermomètre dont la partie sensible est parfaitement sèche, et qui est placé dans le mélange humide. Il s'agit de la température au sens habituel du terme.
On appelle température de rosée tr (en °C) ou Tr (en K) la température à laquelle les premières gouttelettes commencent à apparaître si on refroidit à humidité et pression constantes un mélange humide. Si l'eau se condense sous forme de glace, on parle aussi de température de givre. Il s'agit de la température saturante de l'eau à la pression partielle Pvap.
Avec les notations précédentes, Tr = Tsat(Pvap) si Pvap < Pvs, et Tr = Tsat (Pvs) = T sinon.
On appelle température humide t' (en °C) ou T' (en K), ou plus précisément température de bulbe humide la température indiquée par un thermomètre dont l'élément sensible est recouvert d'une fine pellicule d'eau en cours d'évaporation du fait d'un fort brassage du gaz. En pratique, on recouvre le bulbe du thermomètre par une mèche imbibée d'eau. Si elle est mesurée dans de bonnes conditions, cette température est sensiblement égale à la température de saturation adiabatique que l'on obtiendrait en humidifiant le gaz jusqu'à la saturation dans un appareil adiabatique, en l'aspergeant d'eau à la température d'équilibre.
On peut montrer que sa valeur est donnée par l'équation suivante :
enthalpie liquide de l'eau à t' . ( humidité saturée à t' - humidité initiale) = = enthalpie du mélange saturé à t' - enthalpie du mélange initial à t.
Rapportée au gaz sec, l'équation s'écrit :
hleau(t') (wsat - w) = hgs(t') - hgs(t) + wsat hveau (t') - w hveau(t) (44)
Rapportée aux unités spécifiques, elle devient :
q'(t', wsat) - q'(t,w) = (wsat - w) hleau(t') (45)
Il s'agit d'une équation implicite en t', mettant en jeu le mélange formé d'une part par le gaz sec, et d'autre part par l'eau. Elle peut être inversée dans un intervalle de température compris entre une valeur proche de la température de rosée comme valeur minimale, et la température sèche comme valeur maximale.
Comme indiqué plus haut, il faut prendre garde à ce que les valeurs de référence des enthalpies soient cohérentes entre elles. De plus, lorsque t ou t' devient inférieur à 0 °C, les équations de l'eau liquide doivent être remplacées par celles de l'eau solide.
Diagrammes des mélanges humides (diagrammes psychrométriques)
Les principales relations thermodynamiques que nous venons de donner montrent que les variables et fonctions d'état des mélanges humides sont reliées par des équations relativement complexes, qui justifient de chercher une présentation graphique simple d'emploi.
Deux grandes familles de diagrammes existent : les diagrammes dérivés de celui proposé par Carrier, avec la température sèche en abscisse et l'humidité spécifique en ordonnée (à gauche, figure ci-dessous), et les diagrammes de Mollier (à droite, figure ci-dessous), avec l'humidité spécifique en abscisse et l'enthalpie spécifique en ordonnée.
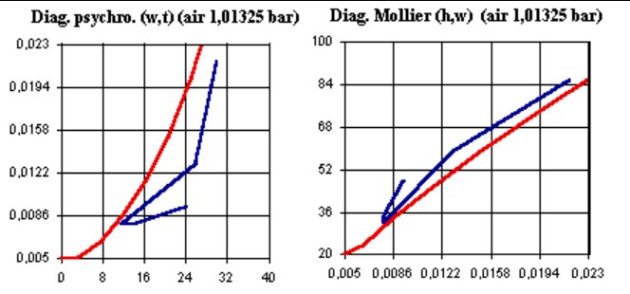
Sur la figure ci-dessus, la courbe régulière en rouge à concavité tournée vers le haut dans le diagramme de Carrier (à gauche) et vers le bas dans le diagramme de Mollier (à droite) est la courbe de saturation en eau du gaz. On a représenté en bleu le tracé d'un cycle de climatisation.
Dans le diagramme de Carrier, la zone située au dessus de la courbe de saturation correspond aux cas où l'eau est en excès et existe sous forme condensée liquide ou solide : le gaz est sursaturé. Dans le diagramme de Mollier, c'est l'inverse : cette zone est située au dessous de la courbe de saturation.
Le diagramme de la figure ci-dessous correspond à l'air à la pression atmosphérique. Il est équipé de différentes isovaleurs :
les courbes d'égale humidité relative ε sont des courbes en bleu à concavité tournée vers le haut ;
les isenthalpes sont les courbes en rouge très proches de droites et les isothermes humides les courbes en vert qui leur sont presque parallèles (en général non représentées) ;
les isovolumes sont les courbes en magenta très proches de droites de pentes négatives plus fortes que les précédentes.
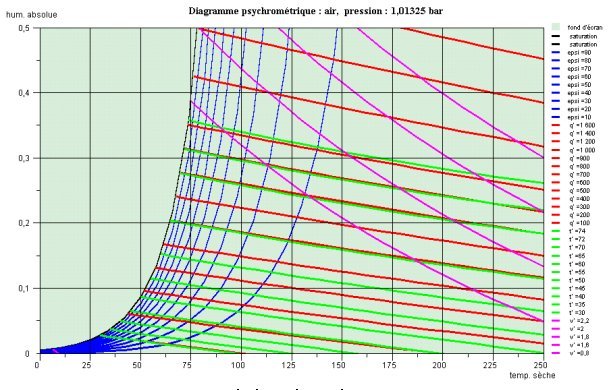
A la pression atmosphérique et au delà de 100 °C, il est impossible de condenser l'eau. Sur le diagramme de Carrier, cela se traduit par une tangente quasi-verticale sur la courbe de saturation pour la température de 100 °C, et sur le diagramme de Mollier par une asymptote pour la courbe de saturation, correspondant à l'isotherme sèche 100 °C.
Utilisation des mélanges humides dans Thermoptim
Vous trouverez ci-dessous une description des principales transformations que peuvent subir des gaz humides. Les écrans Thermoptim de ces transformations sont présentés dans le tome 2 du manuel de référence .
Vous pouvez soit effectuer directement des calculs relatifs aux gaz humides dans Thermoptim, en vous reportant aux exemples donnés dans la documentation, soit inclure des calculs sur les gaz humides dans vos propres classes externes, en vous référant à la note explicative préparée à cet effet .
MÉLANGEURS HUMIDES
Principe
Un mélangeur particulier permet de déterminer les propriétés humides d'un mélange de plusieurs mélanges humides. Cette opération est par exemple réalisée lorsque deux canalisations contenant des mélanges d'humidités différentes se rejoignent pour ne plus former qu'une seule veine. En pratique, il s'agit le plus souvent de mélanges d'air dans des installations de climatisation, par exemple un mélange d'air extérieur et d'air intérieur recyclé.
Equations mises en jeu
Pour deux branches, les équations sont les suivantes :
L'opération étant adiabatique, l'enthalpie totale : q'mél = q'1 + q'2 et le débit-masse total m = m1+ m2 sont toujours conservés.
Il y a généralement conservation de l'humidité spécifique totale :
wtot = w1 + w2
sauf dans le cas où il y a sursaturation, auquel cas une partie de l'eau existe sous forme condensée. Dans ce cas, cette eau liquide doit être soustraite de l'humidité spécifique.
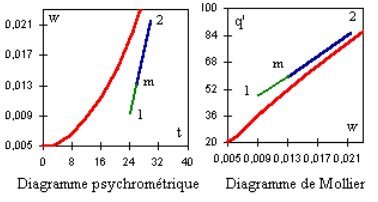
Les trois équations précédentes montrent que, dans un système d'axes (w, q'), et tant qu'il n'y a pas sursaturation, le point représentatif du mélange est le barycentre des deux points représentatifs des deux mélanges humides, affectés des coefficients égaux à leurs débits massiques. Il en résulte que les trois points sont alignés, et que la détermination du mélange peut se faire simplement graphiquement dans un diagramme des mélange humides utilisant ce système d'axes. Dans le diagramme de Carrier (w,t), ce n'est vrai qu'en première approximation.
La représentation du mélange de deux airs humides 1 et 2 dans les diagrammes est donnée figure ci-dessous. Le mélange m se situe au point de jonction des deux segments clair et foncé alignés.
L'enthalpie étant conservée, on commence par chercher les conditions de saturation à q'mél.
Si l'humidité spécifique saturée wsat excède wtot, wmél = wtot. Sinon, wmél = wsat.
La température sèche est dans le premier cas celle qui correspond à q'mél et wmél, et dans le second celle de saturation.
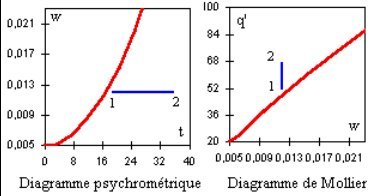
CHAUFFAGE D'UN MÉLANGE HUMIDE
Principe
Le réchauffage d'un mélange humide est une opération qui se fait à humidité constante. Dans le diagramme de Carrier, elle est représentée par un segment horizontal orienté vers la gauche, dans le diagramme de Mollier par un segment vertical orienté vers le haut (figure ci-dessous).
Le chauffage est généralement effectué dans des batteries chaudes qui peuvent être de plusieurs types :
des batteries à ailettes parcourues par de l'eau chaude alimentée par des chaudières ;
des batteries à ailettes formant le condenseur d'une machine frigorifique ;
des batteries électriques chauffées par effet Joule.
Equation mise en jeu
L'équation est la suivante :
ΔQ' = mair (q'2 - q'1)
Après transformation, elle se ramène à :
ΔQ' = mair (1 + w) (hgh2 - hgh1)
hgh étant l'enthalpie du mélange humide.
Si ΔQ' est connu, on inverse l'équation, ce qui donne t2.
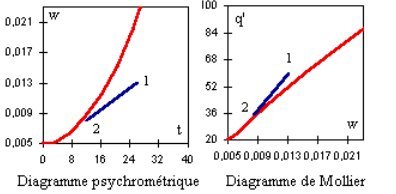
REFROIDISSEMENT D'UN MÉLANGE HUMIDE
Principe
Pour refroidir un mélange humide, on le fait passer dans un échangeur particulier appelé batterie froide, qui peut être refroidi par de l'eau glacée ou par évaporation directe d'un fluide frigorigène. Le mélange étant en contact avec des surfaces froides voit sa température diminuer. Selon les cas, il peut y avoir ou non condensation. S'il n'y a pas de condensation, l'humidité spécifique reste constante, et le refroidissement peut être représenté par un segment horizontal orienté vers la gauche dans le diagramme de Carrier, et vertical orienté vers le bas dans le diagramme de Mollier. S'il y a condensation, ce qui est très souvent le cas, il s'agit d'un segment orienté en bas et à gauche dans les deux diagrammes (figure ci-dessous).
Equations mises en jeu
Un refroidissement théorique parfait dans une batterie froide de dimension infinie conduirait à refroidir le mélange humide jusqu'à la température de la batterie à l'état saturé. On a coutume de qualifier une transformation réelle en prenant ce refroidissement théorique comme référence, en introduisant l'efficacité ε de la batterie froide et sa température moyenne de surface ts.
Pour calculer le point 2, on commence par rechercher les conditions de saturation wsat (ts) :
wsat (ts) = et q'(ts,wsat)
On calcule les conditions humides finales compte tenu de l'efficacité :
ε = (w2 - w1) / (wsat - w1), qui donne :
w2 = ε wsat + (1 - ε) w1
q'2 = ε q'(ts, wsat) + (1 - ε) q'1
On cherche alors t2 tel que q'2 = q'(t2,w2).
Un problème peut survenir lorsque, dans le diagramme psychrométrique, la droite issue du point 1 coupe la courbe de saturation en deux points. En effet, dans ce cas, il se peut que le point calculé à partir de l'efficacité se trouve dans la zone saturée. Il y a alors condensation anticipée. Deux possibilités existent : si l'on impose l'humidité spécifique du point aval w2, le point final se trouve sur la courbe de saturation pour wsat = w2 ; si l'on impose l'efficacité, il se trouve sur la courbe de saturation, pour q'sat = q'2. Il faut donc s'assurer que le point trouvé n'est pas dans la zone saturée.
HUMIDIFICATION D'UN GAZ
HUMIDIFICATION D'UN GAZ : Principe
Pour humidifier un gaz, on peut procéder de deux manières différentes :
en injectant dans le gaz de la vapeur d'eau généralement légèrement surchauffée ou de l'eau pulvérisée en très fines goutelettes de diamètre de 5 à 20 mm par des ultrasons ou de l'air comprimé, en faisant en sorte d'éviter toute condensation sur les parois (figure ci-dessus) ;
en pulvérisant de l'eau pour former une pluie qui vient asperger le gaz (figure ci-dessous) ; la surface de contact entre le gaz et l'eau étant très importante, et le gaz loin de l'état saturé, l'eau se vaporise et l'humidité du gaz augmente. Dans ce dernier cas, la vaporisation de l'eau nécessite un apport de chaleur, qui peut être fourni à la fois par l'eau et le gaz, ou par le gaz seul, auquel cas on parle d'humidification adiabatique. Ce type de dispositif présente cependant des risques de prolifération bactérienne et est donc moins employé.
C'est essentiellement en conditionnement d'air que l'on a recours à l'humidification, par exemple pour humidifier en hiver un air extérieur très sec avant de le souffler dans une ambiance intérieure, ou en été pour assurer un refroidissement passif.
Equations mises en jeu
A l'instar de ce qui a été présenté à propos du refroidissement d'un mélange humide, la référence est une humidification théorique conduisant le gaz à la saturation, l'humidification réelle étant caractérisée par une efficacité e définie comme précédemment.
Cas de l'humidification non adiabatique (eau liquide ou vapeur)
Si l'on connait l'efficacité d'humidification ε, on commence par rechercher les conditions limites de saturation wsat :
wsat = w1 + meau/mair
q'(t,wsat) = q'1 + (wsat - w1) hH2O
avec wsat = MH2O / Mgs . Pvs / (P - Pvs)
On calcule ensuite les conditions humides finales compte tenu de l'efficacité :
w2 = ε wsat + (1 - ε) w1
q'2 = ε q'(t,wsat) + (1 - ε) q'1
On cherche alors t2 tel que q'2 = q'(t2,w2).
Si l'on connait l'eau meau absorbée par le fluide, on calcule directement w2 :
w2 = w1 + meau/mair On cherche alors t2 tel que q'(t2 ,w2) = q'1 + (w2 - w1) heau
Si l'on cherche les conditions limites de saturation, on en déduit l'efficacité ε.
Une humidification par pulvérisation d'eau ou de vapeur se traduit dans le diagramme de Carrier par un segment de droite incliné vers la droite ou vers la gauche selon l'enthalpie du fluide injecté, et dans le diagramme de Mollier par un segment incliné vers la droite. On a représenté figure ci-dessous une humidification avec de la vapeur surchauffée à 115 °C.
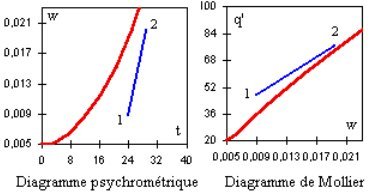
Cas de l'humidification adiabatique
On commence par rechercher les conditions de saturation à la température humide wsat (t') :
wsat (t') = MH2O / Mgs . Pvs / (P - Pvs) et q'(t',wsat)
On calcule les conditions humides finales compte tenu de l'efficacité :
w2 = ε wsat + (1 - ε) w1
q'2 = ε q'(ts,wsat) + (1 - ε) q'1
On cherche alors t2 tel que q'2 = q'(t2,w2)
Une humidification adiabatique se traduit dans le diagramme de Carrier par un segment de droite incliné vers la gauche cor-respondant à t' = Cste, et dans le diagramme de Mollier par un segment quasiment horizontal, q' étant sensiblement constant (figure ci-dessous).
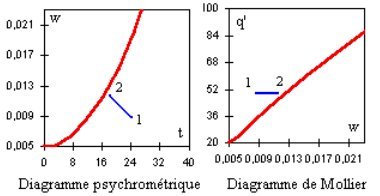
DÉSHUMIDIFICATION D'UN MÉLANGE PAR DESSICCATION
Principe
La déshumidification par dessiccation consiste à faire passer un mélange humide sur un lit d'adsorbant solide hygrophile, qui extrait l'humidité du gaz par effet physique exothermique (adsorption), ou physico-chimique (chimisorption). La régénération du dessicant est réalisée par effet inverse, en le réchauffant. Parmi les systèmes qui permettent de réaliser la dessication, l'un des plus utilisés se présente sous forme d'un échangeur régénérateur rotatif assurant simultanément la déshumidification d'un flux d'air et la régénération d'une partie du dessiccant.
Equation mise en jeu
La même équation gouverne les deux effets.
L'équation de déshumidification par adsorption ou de régénération du dessiccant est fournie par le bilan enthalpique, qui s'écrit ici, Ls étant la chaleur de sorption :
(1 + w2) (hgh(t2) - hgh(0°C)) - (1 + w1) (hgh(t11) - hgh(0°C)) + Ls (w2 - w1) = 0
Si l'on connaît w2, il suffit d'inverser en t2 cette expression, en prenant garde à ce que la composition du mélange humide varie entre les points 1 et 2. Si l'on connaît t2, on obtient w2, en exprimant l'équation précédente en fonction du gaz sec, ce qui conduit à une équation du premier degré en w2.
Une déshumidification par adsorption se traduit dans le diagramme de Carrier par un segment de droite incliné vers la droite, et dans le diagramme de Mollier par un segment proche de l'horizontale, q' augmentant légèrement (figure ci-dessous). Que l'opération se fasse à enthalpie sensiblement constante ne signifie cependant pas qu'elle soit gratuite sur le plan énergétique, étant donné qu'il faut régénérer le dessiccant.
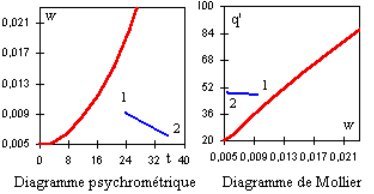
DÉTERMINATION DES CONDITIONS DE SOUFFLAGE
Principe
En climatisation des ambiances, on est souvent confronté au problème suivant : on désire maintenir l'ambiance intérieure d'un bâtiment à une température sèche et une humidité relative données. Les conditions climatiques extérieures sont connues : température sèche, et humidité relative. Il faut évacuer des charges thermiques internes et externes d'une puissance connue, ainsi qu'une quantité d'eau correspondant aux apports internes.
De plus, pour des questions d'hygiène et de confort, la température de soufflage ("supply" en anglais) ne doit généralement pas être inférieure à une certaine valeur, et la proportion d'air recyclé ne doit pas dépasser une limite imposée. Il faut alors déterminer les conditions de soufflage, c'est-à dire le débit et l'état de l'air soufflé, pour que l'ambiance obtenue soit celle désirée.
Equations mises en jeu
1) si le débit d'air est connu, les équations sont les suivantes :
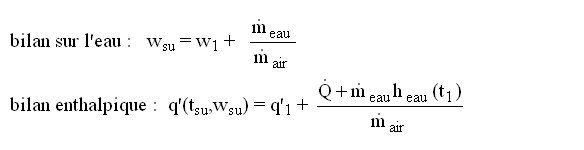
heau(t1) étant l'enthalpie de l'eau à la température t1.
On détermine donc wsu, puis on cherche tsu tel que q' = q'(tsu,wsu).
2) si la température de soufflage est connue, la méthode est la suivante :
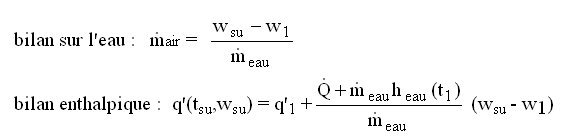
tsu étant connu, on peut calculer wsu avec
q'(tsu,wsu) = hgs(tsu) - hgs(0 °C) + wsu (hH2O(tsu) - hH2O(0 °C)) + wsu L0eau